
Acțiunile UE în domeniul asistenței medicale transfrontaliere: ambiții importante, dar este nevoie de o ameliorare a gestionării
[prezentat în temeiul articolului 287 alineatul (4) al doilea paragraf TFUE]
Informații despre raport Directiva din 2011 privind asistența medicală transfrontalieră are ca scop garantarea drepturilor pacienților din UE de a avea acces la asistență medicală sigură și de înaltă calitate, inclusiv la nivel transfrontalier, în interiorul UE. Aceste drepturi sunt totodată menite să faciliteze o cooperare mai strânsă între statele membre cu privire la e-sănătate și la tratarea bolilor rare. Curtea a concluzionat că, deși acțiunile UE în domeniul asistenței medicale transfrontaliere consolidează colaborarea între statele membre, beneficiile pentru pacienți erau limitate. Curtea a constatat că, în pofida progreselor realizate sub aspectul informării cetățenilor UE cu privire la asistența medicală transfrontalieră, pentru unii dintre aceștia, informațiile respective rămân în continuare greu accesibile. Curtea a identificat deficiențe în ceea ce privește planificarea strategică a Comisiei și gestionarea proiectelor de către aceasta. Curtea formulează recomandări care vizează sprijinul furnizat de Comisie punctelor naționale de contact, implementarea schimburilor transfrontaliere de date medicale și acțiunile întreprinse de UE în domeniul bolilor rare.
Sinteză
IDeși asistența medicală transfrontalieră rămâne pe un loc secundar în comparație cu asistența medicală disponibilă la nivel național, în unele situații, îngrijirea medicală cea mai accesibilă sau cea mai adecvată pentru pacienți este disponibilă doar într-un alt stat membru decât țara de afiliere a pacienților în cauză. Capacitatea pacienților de a alege în mod liber și în cunoștință de cauză accesul la asistența medicală transfrontalieră poate avea ca efect o calitate mai bună a asistenței medicale oferite.
IIDirectiva din 2011 privind asistența medicală transfrontalieră are ca obiectiv garantarea dreptului pacienților din UE de a avea acces la asistență medicală sigură și de înaltă calitate dincolo de frontierele naționale, în interiorul UE, precum și garantarea drepturilor acestora de a li se rambursa costul unei astfel de îngrijiri medicale. Directiva facilitează o cooperare mai strânsă într-o serie de domenii, în special în ceea ce privește schimbul transfrontalier de date ale pacienților și accesul la asistență medicală al pacienților care suferă de boli rare.
IIIAproximativ 200 000 de pacienți recurg, în fiecare an, la sistemele instituite în temeiul directivei, care le permit să beneficieze de tratamente medicale în străinătate: mai puțin de 0,05 % din populația UE. În ultimii ani, Franța a raportat cel mai mare număr de pacienți care au beneficiat de asistență medicală în străinătate, iar Spania a raportat cel mai mare număr de pacienți veniți din alte țări pentru a beneficia de asistență medicală în această țară. Cea mai mare parte a mobilității pacienților s-a înregistrat între state membre învecinate.
IVCurtea a examinat dacă Comisia a supravegheat în mod adecvat punerea în aplicare a directivei în statele membre și dacă a furnizat orientări punctelor naționale de contact responsabile de informarea pacienților cu privire la dreptul acestora la asistență medicală transfrontalieră. Curtea a evaluat dacă rezultatele obținute cu privire la schimburile transfrontaliere de date ale pacienților s-au ridicat la înălțimea așteptărilor și dacă au generat beneficii pentru pacienți. Curtea a examinat, de asemenea, acțiuni-cheie recente întreprinse de UE în domeniul bolilor rare, concentrându-se asupra înființării rețelelor europene de referință. Scopul acestor rețele este de a facilita schimbul de cunoștințe, oferirea de consiliere cu privire la diagnostic și tratament prin consultații virtuale între furnizorii de servicii medicale din toată Europa și ridicarea astfel a nivelului standardelor de calitate privind asistența medicală.
VCurtea concluzionează că, deși acțiunile UE în domeniul asistenței medicale transfrontaliere au consolidat cooperarea dintre statele membre, la data desfășurării acestui audit, impactul asupra pacienților era limitat. Aceste acțiuni sunt ambițioase și necesită o mai bună gestionare.
VIComisia a supravegheat în mod adecvat punerea în aplicare a Directivei privind asistența medicală transfrontalieră. Ea a îndrumat punctele naționale de contact în activitățile acestora de a realiza o mai bună informare cu privire la asistența medicală transfrontalieră, dar mai este loc de îmbunătățiri.
VIILa data auditului Curții, nu avuseseră loc schimburi de date ale pacienților între statele membre și beneficiile unor astfel de schimburi pentru pacienți în cadrul asistenței medicale transfrontaliere nu puteau fi demonstrate. Comisia nu a stabilit un plan de punere în aplicare conținând termene precise pentru noua sa strategie în materie de e-sănătate și nu a estimat volumele de utilizatori potențiali înainte de a implementa schimburile transfrontaliere de date medicale.
VIIIConceptul rețelelor europene de referință pentru boli rare este susținut la scară largă de părțile interesate din UE (organizații ale pacienților, cadre medicale și furnizori de servicii medicale). Cu toate acestea, Comisia nu a prezentat o viziune clară cu privire la finanțarea în viitor a acestor rețele și nici cu privire la modul în care ele ar putea fi dezvoltate și integrate în sistemele de sănătate naționale.
IXPe baza concluziilor sale, Curtea formulează recomandări referitoare la sprijinul furnizat de Comisie punctelor naționale de contact, la implementarea schimburilor transfrontaliere de date medicale și la acțiunile întreprinse de UE în domeniul bolilor rare.
Introducere
01Directiva privind asistența medicală transfrontalieră (denumită în continuare „directiva”)1:
- stabilește drepturile pacienților UE de a avea acces la asistență medicală sigură și de înaltă calitate dincolo de frontierele naționale, în interiorul UE, și drepturile acestora de a li se rambursa costul unei astfel de îngrijiri medicale;
- instituie puncte naționale de contact care să furnizeze cetățenilor informații cu privire la drepturile acestora la asistență medicală transfrontalieră;
- urmărește să faciliteze o cooperare mai strânsă în materie de e-sănătate, inclusiv în ceea ce privește schimburile transfrontaliere de date ale pacienților; și
- urmărește să faciliteze accesul pacienților la asistență medicală pentru bolile rare, în special prin dezvoltarea rețelelor europene de referință.
Drepturile pacienților în cadrul asistenței medicale transfrontaliere
02Asistența medicală ține de competența națională și statele membre finanțează, gestionează și organizează propriile sisteme de sănătate2. Directiva stabilește condițiile în care un pacient poate călători într-o altă țară din UE pentru a primi îngrijiri medicale planificate, care vor fi rambursate în aceleași condiții ca în statul membru de afiliere al pacientului respectiv. Directiva acoperă costurile asistenței medicale, precum și prescrierea și furnizarea de medicamente și de dispozitive medicale, și completează cadrul juridic deja instituit prin Regulamentul UE privind coordonarea sistemelor de securitate socială3 (a se vedea anexa I, în care sunt prezentate comparativ drepturile pacienților, astfel cum sunt prevăzute în directivă și, respectiv, în regulament). Directiva urmărește să faciliteze accesul la o asistență medicală transfrontalieră sigură și de înaltă calitate pe baza unei alegeri libere și în cunoștință de cauză din partea pacienților, întrucât, în unele situații, îngrijirea medicală cea mai accesibilă sau cea mai adecvată pentru pacienți este disponibilă doar într-un alt stat membru decât țara de afiliere a pacienților în cauză. Directiva nu încurajează însă pacienții să recurgă la tratament în străinătate.
03Pacienții care doresc să beneficieze de asistență medicală într-un alt stat membru au dreptul la informații relevante despre standardele de tratament și de îngrijire pe care le are țara respectivă, despre normele de rambursare a costurilor suportate și despre cel mai adecvat temei juridic care ar trebui utilizat. Orice punct național de contact ar trebui să furnizeze aceste informații. Statele membre pot solicita autorizare prealabilă pentru anumite tipuri de asistență medicală, în special pentru tratamente care presupun internarea în spital a pacientului în cauză pentru cel puțin o noapte sau utilizarea unei infrastructuri sau a unui echipament medical foarte specializat. Această autorizare este solicitată în aproximativ 1 % din cazuri.
04Directiva confirmă faptul că, pentru pacienții care beneficiază de asistență medicală în străinătate, costurile suportate ar trebui rambursate de către țara lor de afiliere, cu condiția ca aceștia să aibă dreptul la asistență medicală în țara de afiliere. Nivelul de rambursare a costurilor suportate pentru tratament primit în străinătate este stabilit la nivelul costurilor care ar fi fost suportate în țara de afiliere. Cerința privind plata în avans de către pacienți deși este inerentă concepției directivei, este recunoscută pe scară largă ca fiind o problemă semnificativă pentru pacienți4. Cu toate acestea, directiva prevede pentru statele membre opțiunea de a comunica pacienților o estimare a costurilor asistenței medicale.
05Numărul cetățenilor care solicită rambursarea costurilor îngrijirilor medicale primite în străinătate în temeiul directivei este redus (aproximativ 200 000 de cereri de rambursare pe an – sub 0,05 % din populația UE), în comparație cu numărul celor care recurg la Regulamentul privind coordonarea sistemelor de securitate socială (aproximativ 2 milioane de cereri pe an primite pentru rambursarea costurilor aferente tratamentelor neplanificate primite în străinătate). Cheltuielile privind asistența medicală transfrontalieră suportate în temeiul directivei sunt estimate la 0,004 % din bugetul anual al UE pentru asistență medicală5. În urma unui sondaj Eurobarometru din 2015, mai puțin de 20 % din cetățeni au răspuns că își cunoșteau drepturile privind asistența medicală transfrontalieră. Comisia nu deține date recente cu privire la gradul de informare a cetățenilor în ceea ce privește directiva.
06Gradul de utilizare a directivei variază de la un stat membru la altul. Pentru serviciile de asistență medicală transfrontalieră care nu necesită autorizare prealabilă, Franța a înregistrat cel mai mare număr de pacienți care au primit îngrijiri în străinătate (aproape 150 000 de pacienți în 2016); în schimb, Spania, Portugalia și Belgia au înregistrat cel mai mare număr de pacienți străini care au beneficiat de îngrijiri în aceste țări6. Tabelul 1 prezintă mobilitatea pacienților din toate țările UE și din SEE în temeiul directivei, în 2016, acoperind atât serviciile de asistență medicală transfrontalieră, cât și produsele aferente. Cifrele includ mobilitatea pacienților atât pentru tratamentele care nu necesită autorizare prealabilă (în total, 209 534 de pacienți), cât și pentru tratamentele care necesită o autorizare prealabilă (în total, 3 562 de pacienți).
Tabelul 1 – Mobilitatea pacienților, în temeiul directivei, în 2016
| Pacienți care au beneficiat de tratament în alte țări decât țara lor de afiliere, în 2016 | |
|---|---|
| Țara | Numărul de pacienți |
| FRANȚA | 146 054 |
| DANEMARCA | 25 343 |
| FINLANDA | 11 427 |
| NORVEGIA | 10 301 |
| POLONIA | 8 647 |
| SLOVACIA | 6 110 |
| SLOVENIA | 1 835 |
| REGATUL UNIT | 1 113 |
| IRLANDA | 791 |
| REPUBLICA CEHĂ | 401 |
| LUXEMBURG | 277 |
| ITALIA | 201 |
| CROAȚIA | 200 |
| ROMÂNIA | 130 |
| ESTONIA | 80 |
| ISLANDA | 53 |
| BELGIA | 30 |
| LETONIA | 27 |
| LITUANIA | 19 |
| CIPRU | 13 |
| SPANIA | 11 |
| GRECIA | 10 |
| AUSTRIA | 9 |
| BULGARIA | 5 |
| PORTUGALIA | 5 |
| MALTA | 4 |
| GERMANIA | lipsă date |
| UNGARIA | lipsă date |
| ȚĂRILE DE JOS | lipsă date |
| SUEDIA | lipsă date |
| Total | 213 096 |
| Pacienți care provin din alte țări decât țara de tratament, în 2016 | |
|---|---|
| Țara | Numărul de pacienți |
| SPANIA | 46 138 |
| PORTUGALIA | 32 895 |
| BELGIA | 27 457 |
| GERMANIA | 27 034 |
| LUXEMBURG | 12 530 |
| REPUBLICA CEHĂ | 12 300 |
| ESTONIA | 10 044 |
| ITALIA | 9 335 |
| POLONIA | 6 545 |
| SUEDIA | 6 162 |
| GRECIA | 5 639 |
| UNGARIA | 4 169 |
| AUSTRIA | 2 437 |
| CROAȚIA | 1 680 |
| ȚĂRILE DE JOS | 1 653 |
| REGATUL UNIT | 1 646 |
| ROMÂNIA | 1 003 |
| BULGARIA | 686 |
| IRLANDA | 674 |
| MALTA | 463 |
| FINLANDA | 403 |
| FRANȚA | 371 |
| LITUANIA | 369 |
| NORVEGIA | 327 |
| SLOVACIA | 259 |
| CIPRU | 254 |
| DANEMARCA | 198 |
| LETONIA | 167 |
| ISLANDA | 141 |
| SLOVENIA | 117 |
| Total | 213 096 |
Sursa: Curtea de Conturi Europeană, pe baza raportului privind datele statelor membre legate de asistența medicală transfrontalieră în urma punerii în aplicare a Directivei 2011/24/UE – datele referitoare la anul 2016 sunt disponibile pe site-ul Comisiei.
07Comisia sprijină cooperarea transfrontalieră în domeniul asistenței medicale prin intermediul a numeroase studii și inițiative, inclusiv prin intermediul programului Interreg7, finanțat din fondurile structurale și de investiții europene. Statele membre sunt responsabile pentru gestionarea propriilor sisteme de sănătate și pentru orice acord de cooperare încheiat între ele. Astfel de acorduri de cooperare se încheie adesea fără implicarea Comisiei. Studiul recent al Comisiei privind activitățile și investițiile UE în cooperarea transfrontalieră în domeniul asistenței medicale a identificat 423 de proiecte finanțate de UE8 în sprijinul inițiativelor de colaborare transfrontalieră în domeniul asistenței medicale în perioada cuprinsă între 2007 și 2017.
Schimburile transfrontaliere de date medicale
08Potrivit directivei, Comisia este mandatată să sprijine cooperarea dintre statele membre în domeniul e-sănătății și să stabilească o rețea voluntară de autorități din statele membre (rețeaua de e-sănătate) cu scopul de a sprijini dezvoltarea unor standarde comune pentru transferul de date în cadrul asistenței medicale transfrontaliere. E-sănătate este, de asemenea, o componentă esențială a Strategiei privind piața unică digitală a Comisiei Europene și dezvoltarea e-sănătății în UE este structurată în jurul acțiunilor enumerate în planurile de acțiune pentru e-sănătate ale Comisiei și în strategia privind e-sănătatea din 20189. În 2017, Comisia a lansat, de asemenea, un grup operativ care să analizeze stimulentele și obstacolele legate de realizarea unui schimb securizat de date medicale în UE.
09Comisia, împreună cu statele membre, este în proces de construcție, pe bază voluntară, a unei infrastructuri de servicii digitale de e-sănătate la nivelul UE (eHDSI), menită să permită schimbul de date medicale ale pacienților – în special prescripții electronice și dosare ale pacienților – dincolo de frontierele naționale. Acest proiect include 22 de state membre10 și are drept scop conectarea sistemelor de e-sănătate ale acestora la infrastructura de e-sănătate a UE prin intermediul unui „portal” dedicat, cunoscut drept punctul național de contact pentru e-sănătate (NCPeH) (a se vedea figura 1, care indică procedura pentru schimbul transfrontalier de prescripții electronice).
Figura 1
Schimbul transfrontalier al unei prescripții electronice

Sursa: Curtea de Conturi Europeană.
În unele state membre11, utilizarea prescripțiilor electronice este o practică frecventă. În schimb, alte state membre au început abia recent să experimenteze sau să implementeze servicii de prescripții electronice. Disponibilitatea redusă a serviciilor de e-sănătate la nivel național este una dintre principalele provocări legate de implementarea infrastructurii de e-sănătate la nivelul UE. În plus, unele state membre fie nu participă deloc (de exemplu, Danemarca – a se vedea caseta 1, referitoare la aplicațiile de e-sănătate pentru pacienți), fie participă doar la unele dintre serviciile infrastructurii de e-sănătate la nivelul UE.
Caseta 1
Aplicații de e-sănătate pentru pacienți în Danemarca
Portalul de e-sănătate național – Sundhed.dk (https://www.sundhed.dk) permite pacienților din Danemarca să aibă acces la istoricul lor de prescripții medicale, să vizualizeze consultațiile programate cu furnizorii de servicii medicale și să comande din nou anumite medicamente ei înșiși. În 2018, autoritățile daneze lucrau la un proiect-pilot care urma să adauge elemente noi la portalul de e-sănătate, astfel încât pacienții care consultă un medic în mod frecvent (de exemplu, pentru pacienții care suferă de boli cronice) să își poată programa mai ușor consultațiile.
UE finanțează infrastructura de e-sănătate prin intermediul Mecanismului pentru interconectarea Europei pornind de la un proiect-pilot pentru schimburile transfrontaliere de date medicale
UE finanțează infrastructura de e-sănătate prin intermediul Mecanismului pentru interconectarea Europei pornind de la un proiect-pilot pentru schimburile transfrontaliere de date medicale12. Statele membre care doresc să înceapă să ia parte la schimburile transfrontaliere de date medicale trebuie să treacă printr-un proces de testare și de audit, în urma căruia un grup de experți din statele membre (eHMSEG) formulează o recomandare. Rețeaua de e-sănătate adoptă apoi o decizie finală în legătură cu țările care pot deveni operaționale în cadrul schimburilor transfrontaliere de date medicale.
Inițiativele transfrontaliere pentru pacienții care suferă de boli rare
12Directiva definește bolile rare ca fiind cele care ajung la un prag de răspândire de cel mult 5 persoane afectate din 10 000. Se estimează că între 6 000 și 8 000 de boli rare afectează între 6 % și 8 % din populația UE, cu alte cuvinte, între 27 și 36 de milioane de persoane. Caracteristicile specifice ale bolilor rare – număr limitat de pacienți și lipsa cunoștințelor relevante și a expertizei în domeniu – au determinat Consiliul Uniunii Europene să caracterizeze cooperarea în acest domeniu drept „un domeniu unic cu o valoare adăugată foarte ridicată a acțiunii la nivel comunitar”13.
13Comisia a propus un cadru de politică specific pentru abordarea bolilor rare, în special prin crearea unor rețele europene de referință, în comunicarea sa din 2008 intitulată „Bolile rare: o provocare pentru Europa”. Potrivit directivei, Comisia este mandatată să sprijine statele membre în dezvoltarea rețelelor europene de referință. Figura 2 prezintă evoluțiile succesive în materie de politici, care au dus la înființarea acestor rețele.
Figura 2
Evoluțiile succesive în materie de politici, care au dus la înființarea rețelelor europene de referință
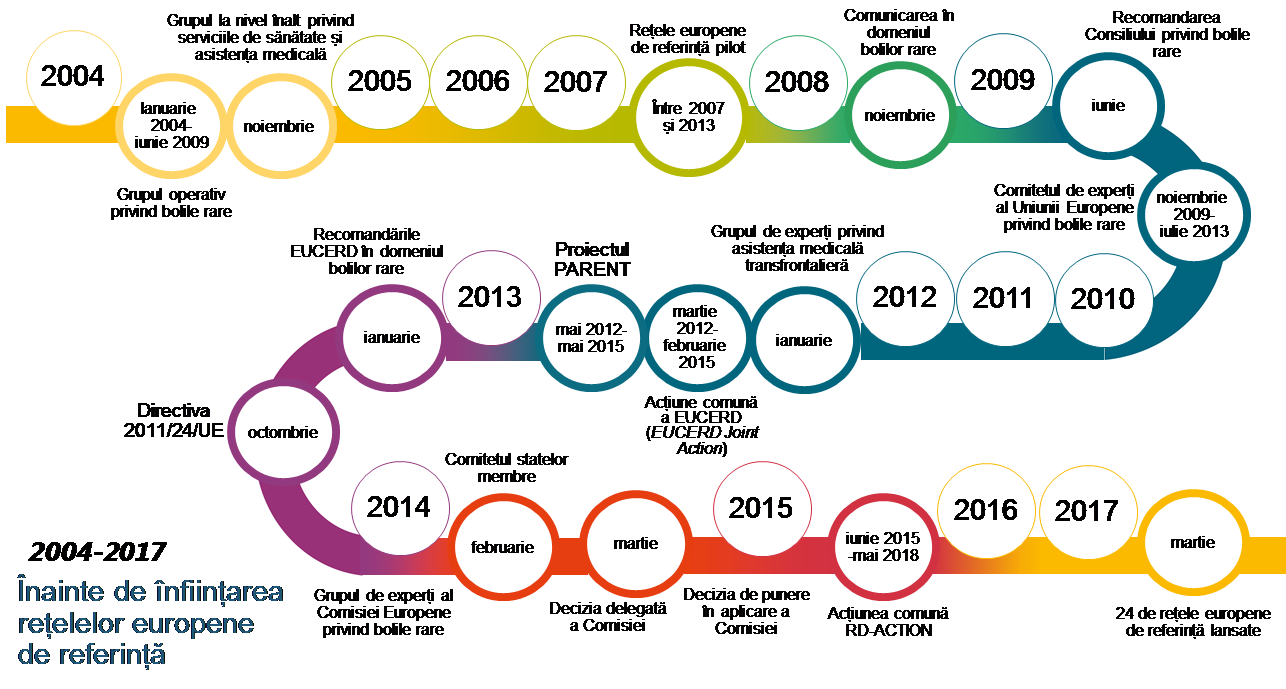
Sursa: Curtea de Conturi Europeană.
Rețelele europene de referință sunt menite să reducă timpul necesar pentru stabilirea diagnosticului și să îmbunătățească accesul la îngrijiri adecvate pentru pacienții care suferă de boli rare, precum și să pună la dispoziție platforme pentru elaborarea de orientări, pentru formare și pentru schimbul de cunoștințe. 24 de rețele au fost lansate în 2017 pentru diferite categorii de boli rare. Fiecare dintre aceste rețele beneficiază de o finanțare de 1 milion de euro pe o perioadă de cinci ani din partea Programului UE în domeniul sănătății. Comisia finanțează de asemenea registre privind pacienții și activități de sprijin pentru rețelele europene de referință, precum și dezvoltarea unor instrumente informatice, în special prin intermediul Mecanismului pentru interconectarea Europei.
15Atunci când cazul unui pacient este prezentat unei rețele europene de referință, este convocată o comisie „virtuală” de experți medicali prin intermediul sistemului de gestionare a pacienților clinici (Clinical Patient Management System – CPMS), o aplicație online pusă la dispoziție de Comisie în noiembrie 2017. Aplicația permite medicilor să facă schimb de informații, de date și de imagini cu privire la pacienți, cu consimțământul acestora din urmă, și să beneficieze de sprijin în ceea ce privește stabilirea diagnosticului și a tratamentului. 73 % dintre membrii rețelelor europene de referință se înregistraseră în vederea utilizării aplicației și 333 de comisii fuseseră create până în decembrie 2018 (a se vedea caseta 2, în care se prezintă exemple de cazuri de pacienți cu boli rare care au fost examinate prin intermediul rețelelor).
Caseta 2
Exemple de cazuri de pacienți cu boli rare care au fost examinate prin intermediul unei rețele europene de referință
În 2018, au fost transmise rețelei europene de referință pentru cancerul pediatric cazurile a doi copii din Lituania diagnosticați cu o formă rară de cancer pediatric. În urma indicațiilor primite din partea unor specialiști prin intermediul rețelei, acestor copii le-au fost prescrise tratamente noi.
În 2017, rețelei europene de referință pentru formele rare și complexe de epilepsie i-a fost transmis cazul unui băiat în vârstă de patru ani din Finlanda care suferea de o anumită anomalie cerebrală care îi provoca episoade grave de epilepsie. Medicul său din Finlanda a consultat specialiștii din cadrul rețelelor europene de referință pentru a solicita consiliere cu privire la tratamentul adecvat. La discuțiile și la schimbul de cunoștințe cu privire la tratamentul pentru acest băiat au participat specialiști din cel puțin șase alte țări.
În ambele cazuri, rețelele europene de referință au oferit o consiliere valoroasă cu privire la tratamentul pacientului respectiv.
Comitetul statelor membre pentru rețelele europene de referință14 aprobă crearea rețelelor, precum și cererile de participare la acestea. La sfârșitul anului 2018, 952 de furnizori de servicii medicale (de exemplu, institute, unități spitalicești) din peste 300 de spitale de pe întreg teritoriul UE participau la rețelele europene de referință. Niciuna dintre rețele nu acoperea mai mult de 19 state membre. Figura 3 arată că distribuția geografică a furnizorilor de servicii medicale care au calitatea de membri ai rețelelor europene de referință variază în UE. Cel mai mare număr de furnizori de servicii medicale care participă la rețelele europene de referință provine din Italia. Acest stat membru dispune de mult timp de o strategie națională pentru acțiuni în domeniul bolilor rare, precum și de o rețea națională de spitale și centre specializate și calificate în asistența medicală acordată pacienților care suferă de boli rare.
Figura 3
Distribuția geografică în UE a furnizorilor de servicii medicale care au calitatea de membri ai rețelelor europene de referință

Sursa: Curtea de Conturi Europeană, pe baza datelor furnizate de Comisie cu privire la furnizorii de servicii medicale care au calitatea de membri ai rețelelor europene de referință, pentru fiecare stat membru, februarie 2019.
Sfera și abordarea auditului
17Unul dintre obiectivele strategice ale Curții de Conturi Europene (Curtea) constă în a examina performanța în domeniile în care acțiunile UE prezintă importanță pentru cetățeni15. Îmbunătățirea infrastructurii și a serviciilor de sănătate din Europa, precum și a accesibilității și a eficacității acestora, este un domeniu în care acțiunea UE poate aduce o valoare adăugată pentru cetățenii UE. Curtea a inițiat acest audit după 10 ani de la aprobarea de către Comisie a strategiei acesteia privind bolile rare și de la demararea principalului proiect-pilot al UE pentru schimburile transfrontaliere de date medicale. În cadrul auditului său, Curtea a urmărit să răspundă la întrebarea următoare:
Acțiunile întreprinse de UE în materie de asistență medicală transfrontalieră generează beneficii pentru pacienți?
18Curtea a examinat dacă:
- Comisia supraveghea în mod adecvat punerea în aplicare în statele membre a Directivei UE privind asistența medicală transfrontalieră;
- rezultatele obținute până în prezent în ceea ce privește schimburile transfrontaliere de date medicale se ridică la nivelul așteptărilor;
- acțiunile UE privind bolile rare aduc o valoare adăugată la eforturile statelor membre de a facilita accesul pacienților la asistență medicală transfrontalieră.
Auditul Curții a acoperit perioada cuprinsă între adoptarea strategiei Comisiei în domeniul bolilor rare și lansarea în 2008 a proiectului-pilot principal al UE pentru schimburile transfrontaliere de date medicale. Activitățile de audit ale Curții au fost efectuate în perioada februarie-noiembrie 2018 și aceasta a desfășurat interviuri cu reprezentanți ai Comisiei din partea Direcției Generale Sănătate și Siguranță Alimentară (DG SANTE), a Direcției Generale Rețele de Comunicare, Conținut și Tehnologie și a Centrului Comun de Cercetare (DG JRC), precum și cu autoritățile responsabile pentru punerea în aplicare a directivei din cinci state membre16. La selecția statelor membre de către Curte s-au luat în considerare principalele proiecte finanțate de UE pentru schimburile transfrontaliere de date medicale.
20De asemenea, Curtea a realizat un sondaj în rândul reprezentanților statelor membre în cadrul Grupului de experți privind asistența medicală transfrontalieră pentru a obține opiniile acestora cu privire la principalele evoluții și provocări legate de accesul pacienților la asistență medicală transfrontalieră, precum și în rândul reprezentanților rețelei de e-sănătate cu privire la opinia acestora în legătură cu activitatea Comisiei în ceea ce privește schimburile transfrontaliere de date ale pacienților. Curtea a primit 15 răspunsuri din partea Grupului de experți privind asistența medicală transfrontalieră și 10 răspunsuri din partea rețelei de e-sănătate.
21Curtea a auditat proiecte finanțate de UE care vizau facilitarea accesului la asistență medicală transfrontalieră, inclusiv pe cele care vizau schimbul de date medicale la nivel transfrontalier și dezvoltarea și mentenanța Platformei europene pentru înregistrarea bolilor rare. Curtea a constituit o comisie de experți pentru a obține consiliere independentă cu privire la politica UE în domeniul bolilor rare și la rețelele europene de referință.
Observații
Comisia s-a asigurat că Directiva UE privind asistența medicală transfrontalieră a fost pusă în aplicare
22Pentru a putea supraveghea punerea în aplicare a directivei, Comisia trebuie să monitorizeze și să se asigure de transpunerea acesteia în statele membre prin controale de exhaustivitate și de conformitate. De asemenea, Comisia trebuie să prezinte un raport privind aplicarea directivei și să ghideze în mod corespunzător punctele naționale de contact responsabile pentru informarea pacienților cu privire la asistența medicală transfrontalieră.
Comisia a monitorizat transpunerea directivei și s-a asigurat de transpunerea acesteia
23După expirarea termenului de 25 octombrie 2013 care fusese stabilit pentru transpunerea directivei și în urma verificărilor efectuate de Comisie cu privire la caracterul complet al transpunerii acesteia în statele membre, Comisia a inițiat 26 de proceduri de constatare a neîndeplinirii obligațiilor pentru notificarea tardivă sau incompletă a măsurilor de transpunere. În plus, Comisia a inițiat 21 de proceduri de constatare a neîndeplinirii obligațiilor pentru transpunerea tardivă sau incompletă a Directivei de punere în aplicare privind recunoașterea prescripțiilor medicale emise în alt stat membru17. După ce toate statele membre au furnizat notificări complete ale măsurilor de transpunere, Comisia a închis, înainte de noiembrie 2017, procedurile respective.
24Comisia verifică legislația statelor membre pentru a stabili dacă acestea au transpus în mod corect dispozițiile directivei. Pentru ca aceste verificări să fie bine direcționate, Comisia a identificat patru domenii prioritare care prezintă impedimente pentru pacienți în cadrul asistenței medicale transfrontaliere, și anume: sistemele de rambursare, utilizarea autorizării prealabile, cerințele administrative și facturarea pacienților care provin din alte țări. În urma acestor verificări, Comisia a deschis din proprie inițiativă 11 proceduri de constatare a neîndeplinirii obligațiilor, dintre care patru au fost închise înainte de noiembrie 2018, după ce statele membre au modificat măsurile de transpunere la nivel național.
25Curtea consideră că verificările efectuate de Comisie au dus la îmbunătățiri în sistemele și practicile utilizate de statele membre.
Comisia a raportat cu privire la aplicarea directivei în timp util
26Începând din 2015, Comisia are obligația de a elabora, o dată la trei ani, un raport cu privire la aplicarea directivei18. Aceste rapoarte ar trebui să includă informații referitoare la fluxurile de pacienți și la costurile legate de mobilitatea pacienților. Deși directiva nu obligă statele membre să colecteze date privind fluxurile de pacienți, ea precizează că acestea trebuie să furnizeze Comisiei asistența și toate informațiile disponibile pentru elaborarea raportului. În 2013, statele membre au acceptat să furnizeze anual Comisiei date specifice.
27Majoritatea statelor membre au înregistrat întârzieri în ceea ce privește adoptarea măsurilor de transpunere la nivel național (a se vedea punctul 23) și acest lucru a întârziat transmiterea datelor către Comisie în 2015. În 2017, 26 de state membre au furnizat datele respective, însă, pentru șase dintre acestea, datele erau incomplete. În plus, datele nu erau comparabile de la o țară la alta, întrucât unele state membre au raportat toate rambursările fără a specifica dacă acestea au fost acordate în temeiul directivei sau în temeiul Regulamentului privind coordonarea sistemelor de securitate socială. Comisia a recunoscut că acuratețea datelor incluse în rapoarte era una limitată. De exemplu, imaginea de ansamblu a fluxurilor de pacienți era incompletă. În tabelul 1 se observă că patru state membre nu au furnizat date privind fluxurile de pacienți care au beneficiat de asistență medicală în alte țări decât țara lor de afiliere în 2016.
28În pofida acestor dificultăți, Comisia s-a achitat de obligația sa de raportare în timp util. Ea a adoptat cel mai recent raport în septembrie 2018 și a publicat o prezentare generală a fluxurilor de pacienți și a impactului financiar al asistenței medicale transfrontaliere acordate în temeiul directivei.
Comisia a oferit îndrumări punctelor naționale de contact în vederea îmbunătățirii informațiilor privind asistența medicală transfrontalieră
29Comisia sprijină și îndrumă punctele naționale de contact pentru ca acestea să furnizeze informații clare și cuprinzătoare privind drepturile pacienților la asistență medicală transfrontalieră. În acest sens, Comisia a publicat mai multe studii relevante19. Înainte de termenul stabilit pentru transpunerea directivei, Comisia a transmis statelor membre, în 2013, o notă de orientare cu privire la căile de urmat care erau disponibile pentru pacienți în cazul în care aceștia doreau să beneficieze de tratament medical în cadrul asistenței medicale transfrontaliere: Directiva privind asistența medicală transfrontalieră și Regulamentul privind coordonarea sistemelor de securitate socială.
30Cu toate acestea, mai puțin de jumătate dintre site-urile punctelor naționale de contact conțineau explicații cu privire la cele două căi diferite pe care pacienții le pot urma pentru a beneficia de asistență medicală în alte țări20. În martie 2018, Comisia a încercat să abordeze posibila confuzie care s-ar putea face între cele două acte legislative prin organizarea unui atelier de consolidare a capacităților pentru punctele naționale de contact și prin dezvoltarea unui set de instrumente practice care să le ajute pe acestea să transmită informațiile către pacienți. Sondajul realizat de Curte a arătat că autoritățile competente din statele membre considerau aceste seturi de instrumente ca fiind binevenite, dar și că sunt necesare eforturi suplimentare pentru a le ajuta să explice mai bine pacienților diferențele existente.
31Conform unui studiu recent al Comisiei21, informațiile aflate la dispoziția pacienților pe site-urile punctelor naționale de contact erau, în general, adecvate și îndeplineau cerințele directivei, dar studiul a arătat totodată că site-urile ar putea oferi mai multe informații privind drepturile pacienților care provin din alte țări decât cea de tratament și privind rambursarea costurilor asistenței medicale transfrontaliere pentru pacienții care beneficiază de asistență medicală în străinătate. În plus, într-un raport privind directiva publicat de Parlamentul European s-a arătat că „în general, pe site-urile de internet ale PNC nu există informații detaliate cu privire la drepturile pacienților”22.
32În directivă nu există nicio cerință care să oblige punctele naționale de contact să includă informații cu privire la rețelele europene de referință pe site-urile lor. Curtea a constatat că unele dintre punctele naționale de contact au furnizat astfel de informații, iar altele analizau modul în care să facă acest lucru. Reprezentanții Germaniei, Irlandei, Estoniei, Lituaniei și ai Regatului Unit și-au exprimat deja interesul în stabilirea unui contact cu Comitetul statelor membre pentru rețelele europene de referință23. Experții în domeniul bolilor rare care au fost consultați de Curte considerau că punctele naționale de contact ar trebui să furnizeze astfel de informații cu privire la rețele.
Schimbul transfrontalier de date medicale privind pacienții: rezultatele obținute până la data desfășurării auditului nu se ridicaseră la înălțimea așteptărilor mari
33Crearea unor mecanisme pentru schimbul de date medicale ale pacienților în cadrul UE necesită un cadru de guvernanță strategic și clar, susținut de statele membre. Trebuie stabilite obiective clare și performanța trebuie monitorizată în mod regulat. Înainte de a lansa proiectele pe scară largă, Comisia, cu sprijinul statelor membre, ar trebui să estimeze volumele de utilizatori potențiali. Ar trebui să se tragă învățăminte din proiectele-pilot anterioare.
Strategia din 2018 în domeniul e-sănătății nu includea un plan de punere în aplicare
34Planurile de acțiune privind e-sănătatea ale Comisiei au prezentat abordarea acesteia în materie, inclusiv în ceea ce privește schimburile transfrontaliere de date medicale ale pacienților. Actualul plan de acțiune acoperă perioada 2012 2020. În aprilie 2018, Comisia a adoptat o nouă strategie în domeniul e-sănătății24, care are o sferă de cuprindere mai largă decât actualul plan de acțiune. Această strategie include în special o posibilă extindere care acoperă schimbul transfrontalier de dosare medicale electronice.
35În 2014, Comisia a publicat o evaluare intermediară a Planului de acțiune privind e-sănătatea25. Deși, în ansamblu, evaluarea a fost pozitivă, aceasta a evidențiat unele deficiențe și a recomandat Comisiei să actualizeze planul pentru a include aspectele cele mai relevante, pentru a oferi o structură clară de guvernanță și pentru a crea un mecanism de monitorizare și de coordonare.
36Comisia a pus în aplicare majoritatea acțiunilor prevăzute în Planul de acțiune privind e-sănătatea. Ea nu a dat curs recomandării din evaluarea din 2014, și anume aceea de a-și actualiza planul de acțiune, și nici nu a revizuit acest plan pentru a reflecta Strategia din 2018 privind e-sănătatea. Prin urmare, planul nu include aspecte relevante, cum ar fi introducerea Regulamentului general privind protecția datelor. În plus, Comisia nu a specificat responsabilitățile pentru punerea în aplicare a acestui plan.
37Strategia din 2018 în domeniul e-sănătății se referă la noile provocări, cum ar fi introducerea Regulamentului general privind protecția datelor și amenințările la adresa securității cibernetice. Această strategie nu includea însă un plan de punere în aplicare conținând termene precise pentru obținerea rezultatelor și a realizărilor preconizate, ceea ce ar indica abordarea adoptată de Comisie pentru punerea în aplicare a strategiei în domeniul e-sănătății. La data la care Comisia a lansat strategia sa din 2018 privind e-sănătatea, singura evaluare a planului său de acțiune 2012 2020 data din 2014.
Comisia a subestimat dificultățile pe care le implica implementarea infrastructurii de e-sănătate la nivelul UE
38Lucrările Comisiei cu privire la schimburile de date medicale ale pacienților între statele membre s-au desfășurat în două etape: un proiect-pilot (epSOS)26 derulat între 2008 și 2012, ale cărui costuri s-au ridicat la 18 milioane de euro, și un proiect aflat în prezent în faza de implementare (EU-wide eHealth Digital Service Infrastructure – infrastructura de servicii digitale de e-sănătate la nivelul UE), cu un buget de 35 de milioane de euro27, lansat în 2015.
39Obiectivul epSOS a fost acela de a crea un cadru și o infrastructură de tehnologie a informației și comunicațiilor care să permită accesul transfrontalier securizat la informații privind sănătatea pacienților. Proiectul-pilot a constat în testarea fezabilității funcționale, tehnice și juridice, precum și în acceptarea soluției propuse pentru schimbul transfrontalier de date medicale. Scopul său era acela de a „demonstra implementarea efectivă a soluției într-o serie de contexte existente în mai multe state participante”.
40Proiectul a dezvoltat definițiile conținutului de date ale dosarelor pacienților și ale prescripțiilor electronice (a se vedea punctul 09), precum și mecanismele de testare, de revizuire și de aprobare a schimburilor transfrontaliere de date medicale. Acesta a contribuit la dezvoltarea specificațiilor și a orientărilor în materie de interoperabilitate a serviciilor de e-sănătate. De asemenea, proiectul a furnizat standarde comune pentru promovarea acestor schimburi și a demonstrat angajamentul statelor membre pentru cooperarea în acest domeniu.
41Etapa de planificare a proiectului nu a stabilit sfera și amploarea testelor necesare înainte de implementarea efectivă. Testarea fezabilității soluției propuse a constat în efectuarea a 43 de transferuri de date ale pacienților. Acest lucru însemna că proiectul oferea un nivel limitat de demonstrare practică a soluției propuse. În faza de evaluare finală a proiectului, evaluatorii externi au concluzionat că numărul de dosare ale pacienților și de prescripții electronice efective „era prea mic pentru a considera serviciile epSOS ca fiind operaționale și solide”28. Comisia a considerat că acest schimb, deși limitat, era suficient pentru a demonstra fiabilitatea infrastructurii de servicii digitale de e-sănătate.
42Comisia a evaluat proiectul epSOS în 2014. Această evaluare a arătat că, „deși așteptările privind cifrele relevante din punct de vedere statistic privind schimburile legate de pacienți nu fuseseră încă atinse în cadrul proiectului epSOS, conceptul abordării epSOS pentru interoperabilitatea la nivel transfrontalier a fost dovedit ca fiind valid”29. În plus, problemele legate de interoperabilitate la nivel juridic, organizațional și semantic s-au dovedit a fi o provocare mai mare decât se preconizase. Comisia a identificat totodată declarații de cheltuieli neeligibile depuse de contractanții proiectului, care erau în cea mai mare parte legate de costurile cu personalul. La data auditului Curții, era în curs procesul de recuperare de către Comisie a cheltuielilor neeligibile, care reprezentau 42 % din finanțarea acordată.
43În pofida acestor provocări, în 2015, Comisia a decis să utilizeze realizările proiectului-pilot ca bază pentru dezvoltarea infrastructurii de e-sănătate pe scară largă la nivelul UE (eHDSI). Arhitectura eHDSI, specificațiile semantice și tehnice, precum și acordurile de natură juridică, organizațională și în materie de politici între statele membre participante se bazează pe elementele livrabile ale proiectului epSOS.
44Curtea a identificat deficiențe în ceea ce privește gradul de pregătire al Comisiei pentru acest proiect complex, în special o estimare insuficientă a volumelor de utilizatori potențiali (pacienți și furnizori, adică farmacii sau spitale) ai serviciilor de e-sănătate transfrontaliere pe care eHDSI le oferă și o evaluare insuficientă a raportului cost-eficacitate al acestor servicii înainte de lansarea eHDSI. Prin urmare, conform constatărilor Curții, Comisia a subestimat dificultățile pe care le implica implementarea unei infrastructuri de e-sănătate la nivelul UE.
Comisia a supraestimat gradul probabil de utilizare a infrastructurii de servicii digitale în domeniul e-sănătății
45Comisia s-a dovedit a fi excesiv de optimistă în declarațiile sale cu privire la nivelul probabil al schimburilor transfrontaliere de date medicale (a se vedea caseta 3).
Caseta 3
Declarațiile Comisiei cu privire la gradul de utilizare a infrastructurii de e-sănătate la nivelul UE
În decembrie 2017, Comisia a anunțat că: „În 2018, 12 state membre ale UE vor începe să facă schimb de date privind pacienții în mod regulat”30.
Pe site-ul său privind guvernanța infrastructurii de e-sănătate, Comisia a afirmat că „se preconizează că, în jurul anului 2019, schimbul transfrontalier de date medicale în UE va începe să fie o practică acceptată a sistemelor de sănătate naționale […]”31.
La evaluarea propriei performanțe, Comisia a raportat, în 2017, că 10 state membre „aveau capacitatea de a face schimb de date medicale și de a se alătura serviciilor informaționale de e-sănătate transfrontaliere”32. Această cifră s-a bazat pe informațiile declarate de statele membre înseși la o întrebare legată de crearea portalurilor lor naționale de e-sănătate și a inclus state membre care abia începuseră să își dezvolte astfel de portaluri, dar care nu confirmaseră că erau pregătite să înceapă să facă schimb de date medicale la nivel transfrontalier.
Până la data auditului Curții (noiembrie 2018), schimburile de date medicale ale pacienților la nivel transfrontalier prin intermediul infrastructurii de e-sănătate la nivelul UE nu începuseră încă (a se vedea anexa II, care indică datele planificate pentru intrarea în etapa operațională a schimburilor de date medicale transfrontaliere în statele membre). Până la data respectivă, Comisia evaluase capacitatea a șapte state membre33 de a deveni operaționale în vederea schimburilor transfrontaliere. Patru dintre aceste state membre (Republica Cehă, Estonia, Luxemburg și Finlanda) făcuseră obiectul unor controale de urmărire subsecventă. În octombrie 2018, eHMSEG a recomandat ca acestea să devină operaționale, cu condiția să fi fost luate toate măsurile corective. Figura 4 prezintă procesul prin care statele membre se alătură serviciilor informaționale de e-sănătate transfrontaliere și situația din 2018.
Figura 4
Procesul prin care statele membre se pot alătura serviciilor informaționale de e-sănătate transfrontaliere – situația în 2018

Sursa: Curtea de Conturi Europeană, pe baza informațiilor furnizate de Comisie.
De asemenea, Curtea a constatat că aceste patru state membre care au fost acceptate să participe la infrastructura de e-sănătate la nivelul UE acopereau diferite tipuri de servicii de e-sănătate. La data desfășurării auditului, Finlanda era pregătită să trimită prescripții electronice, în timp ce Estonia le putea primi (la începutul anului 2019, acesta era singurul schimb de prescripții electronice disponibil în Europa). Potrivit Comisiei, 550 de prescripții electronice au fost prelucrate în acest mod între ianuarie 2019 și sfârșitul lunii februarie 2019. Republica Cehă și Luxemburg erau pregătite să primească dosare electronice ale pacienților din străinătate, dar niciun stat membru nu le putea încă trimite prin intermediul eHDSI. În plus, la început, numai o parte dintre farmaciile și furnizorii de servicii medicale din țările respective vor utiliza sistemul. În caseta 4 se explică modul în care pacienții ar putea beneficia de schimburile transfrontaliere de prescripții electronice și de dosarele electronice ale pacienților.
Caseta 4
Schimburile transfrontaliere
Prescripțiile electronice (cazul Finlandei și al Estoniei),
Atunci când un pacient căruia i s-a emis o prescripție electronică în această țară merge la o farmacie din Estonia pentru a obține medicamentul respectiv, farmacia în cauză ar trebui să înregistreze numărul de identificare al pacientului. Farmacia ar trebui apoi, cu consimțământul pacientului, să trimită datele din prescripție către portalul estonian de e-sănătate (NCPeH), care ar trebui să le transmită, la rândul său, portalului de e-sănătate finlandez. După eliberarea medicamentului de către farmacia din Estonia, portalul de e-sănătate finlandez ar trebui să fie informat că prescripția electronică a fost prelucrată (a se vedea figura 1).
și dosarele electronice ale pacienților
Atunci când o persoană are o urgență medicală sau face o vizită medicală neplanificată la un furnizor de servicii medicale în străinătate, personalul medical ar putea să aibă acces pe cale electronică la informațiile medicale de bază cu privire la pacient din țara de afiliere a acestuia prin intermediul portalului de e-sănătate al UE. Dosarele pacienților pot include informații cu privire la posibilele alergii ale acestora la anumite medicamente și pot facilita stabilirea diagnosticului în străinătate.
Rețelele europene de referință pentru bolile rare reprezintă o inițiativă ambițioasă, dar sustenabilitatea lor nu a fost demonstrată
48Pentru ca statele membre să poată fi sprijinite în mod eficace de Comisie în dezvoltarea rețelelor europene de referință, acest sprijin trebuie furnizat în contextul cadrului juridic în materie, pe baza unei strategii coerente și pe baza unei foi de parcurs clare.
Comisia nu a actualizat cadrul său pentru acțiunile UE în domeniul bolilor rare
49Dezvoltarea rețelelor europene de referință face parte din politica mai amplă a UE privind bolile rare, care include elemente precum sprijinul pentru dezvoltarea unor planuri naționale vizând bolile rare, o mai bună standardizare a nomenclaturii bolilor rare și sprijinul pentru cercetare în domeniul bolilor rare. Comunicarea din 2008 a Comisiei privind bolile rare urmărește „să încurajeze cooperarea dintre statele membre și, dacă este necesar, să sprijine acțiunile lor în acest sens”. Obiectivul era „să stabilească o strategie comunitară generală de sprijinire a statelor membre”34 în abordarea bolilor rare. Consiliul a avizat această abordare în recomandarea sa din 8 iunie 2009 privind o acțiune în domeniul bolilor rare35.
50Comisia a publicat în 2014 un raport privind punerea în aplicare atât a comunicării, cât și a recomandării Consiliului. Raportul concluzionează că „[î]n ansamblu, obiectivele comunicării și ale recomandării Consiliului au fost realizate”. Printre aceste obiective se numără stabilirea unei definiții clare a bolilor rare sau realizarea de progrese în privința codificării bolilor rare în sistemele de sănătate. Acest raport atrage însă atenția asupra faptului că „mai trebuie depuse multe eforturi” pentru a garanta pacienților din întreaga UE care suferă de boli rare că pot beneficia de îngrijirile de care au nevoie și indică faptul că absența unor strategii în domeniul bolilor rare în unele state membre este un domeniu care necesită eforturi suplimentare. Raportul enumeră 11 acțiuni pe care Comisia le are în vedere, inclusiv asigurarea continuității sprijinului pentru Platforma europeană pentru bolile rare și pentru elaborarea unor planuri în domeniul bolilor rare.
51În pofida concluziei potrivit căreia obiectivele fuseseră atinse, nouă dintre cele 11 acțiuni preconizate sunt o continuare a inițiativelor existente. Comisia nu și-a actualizat din 2008 strategia în materie de boli rare, deși gestionează inițiative importante, cum ar fi rețelele și platforma la nivelul UE pentru crearea unor registre privind bolile rare.
Comisia nu a aplicat toate lecțiile învățate din rețelele europene de referință pilot
52Comisia a finanțat zece rețele de referință pilot între 2007 și 2013. Comitetul de experți al Uniunii Europene privind bolile rare (EUCERD)36 a evaluat aceste rețele europene de referință pilot și a publicat, în 2011, o analiză preliminară a rezultatelor și a experienței rețelelor europene de referință pilot pentru bolile rare (Preliminary analysis of the outcomes and experiences of pilot European Reference Networks for rare diseases). Cu toate acestea, atunci când Comisia a creat rețelele europene de referință, ele abordau doar câteva dintre aspectele evidențiate în evaluarea din 2011, de exemplu, sprijinul pentru registrele privind pacienții, necesitatea unui instrument specific pentru tehnologia informației și comunicațiilor și necesitatea ca fiecare membru al rețelei să dispună de procese de control al calității pentru practicile sale de îngrijire a pacienților. Printre aspectele nesoluționate se numără următoarele:
- sustenabilitatea rețelelor după perioada inițială de finanțare;
- dezvoltarea unui sistem de monitorizare continuă și de control permanent al calității pentru membrii rețelei;
- provocările administrative și costurile financiare pe care le prezintă extinderea unei rețele și
- sprijinul sustenabil pentru registrele privind pacienții.
Încă de la lansarea sa în 2014, Comitetul statelor membre pentru rețelele europene de referință a continuat să caute soluții pentru aceste aspecte nerezolvate. Comitetul a înregistrat progrese în ceea ce privește monitorizarea continuă și controlul permanent al calității (pentru care acesta a aprobat, în septembrie 2018, un set de indicatori de bază colectați de rețelele europene de referință). Au intervenit însă chestiuni noi, cum ar fi integrarea rețelelor în sistemele de sănătate naționale și colaborarea cu industria din domeniu, care nu au fost încă soluționate. Figura 5 ilustrează diferitele provocări cu care se confruntă rețelele și la care Comisia, Comitetul statelor membre sau Grupul de coordonatori ai rețelelor încearcă, în prezent, să răspundă.
Figura 5
Provocări pentru dezvoltarea rețelelor europene de referință

Sursa: Curtea de Conturi Europeană, pe baza proceselor-verbale ale Comitetului statelor membre pentru rețelele europene de referință.
Comisia a sprijinit înființarea a 24 de rețele europene de referință, dar nu a creat un sistem eficace pentru evaluarea participanților
54Potrivit directivei, Comisia este mandatată să stabilească criterii și condiții specifice pe care furnizorii de servicii medicale trebuie să le îndeplinească pentru a se alătura unei rețele europene de referință37. Comisia a recurs la serviciile unui consultant pentru a elabora un set de orientări pentru solicitanții de afiliere la rețele, precum și pentru organismul de examinare independent, care a evaluat rețelele europene de referință și cererile transmise de fiecare furnizor de servicii medicale. Comisia a depus eforturi pentru a crește gradul de sensibilizare cu privire la lansarea rețelelor europene de informare în rândul părților interesate relevante și obiectivul său inițial de a sprijini crearea a zece rețele europene de referință38 a fost depășit, întrucât au fost create 24 de astfel de rețele (a se vedea anexa III, care prezintă o listă a rețelelor europene de referință).
55Figura 6 ilustrează procesul de examinare a cererilor furnizorilor de servicii medicale privind alăturarea la rețelele europene de referință. Înainte de depunerea cererii, fiecare furnizor de servicii medicale trebuie mai întâi să fie avizat de către autoritatea competentă a statului membru respectiv. Procedura de evaluare la nivelul UE s-a limitat la o verificare a eligibilității cererilor și la evaluarea unui eșantion de 20 % din cererile individuale.
Figura 6
Arborele de decizie privind verificarea eligibilității și procesul de evaluare a cererilor primite din partea furnizorilor de servicii medicale pentru a se alătura rețelelor europene de referință

Sursa: analiza Curții de Conturi Europene, bazată pe documente furnizate de Agenția Executivă pentru Consumatori, Sănătate, Agricultură și Alimente.
Organismul de examinare independent a elaborat 62 de rapoarte preliminare negative. În toate aceste cazuri, solicitanții au furnizat informații39 cu privire la chestiunile nesoluționate, care au permis organismului de examinare să emită un aviz favorabil. Cu toate acestea, în urma examinării de către Curte a unui eșantion40 de rapoarte de evaluare, aceasta a constatat că, în multe cazuri, organismul de are a emis avizul său final pozitiv pe baza unor informații incomplete. Rezultatul final al procesului de examinare a constat în acceptarea înscrierii în rețelele europene de informare a 952 de furnizori de servicii medicale dintre cei 953 care au trimis cereri în acest sens. Curtea concluzionează că, în practică, acest proces de examinare a adus o valoare adăugată limitată la înființarea rețelelor europene de referință.
57Sistemul de examinare pe bază de eșantionare nu era inițial completat de nicio o altă măsură de monitorizare sau de evaluare. Începând din decembrie 2016, Comisia a colaborat cu reprezentanții statelor membre și cu coordonatorii rețelelor europene de referință în vederea dezvoltării unui sistem de monitorizare continuă din partea sa și în vederea unei autoevaluări periodice a tuturor membrilor rețelelor. Cu toate acestea, la data desfășurării auditului, părțile implicate nu hotărâseră ce măsuri să fie luate în cazul în care acest sistem de monitorizare identifică furnizori de servicii medicale neperformanți. De asemenea, Comisia intenționează să evalueze rețelele europene de referință după încheierea perioadei lor de finanțare de cinci ani41.
Bugetul UE nu conține o linie bugetară specifică pentru rețelele europene de referință
58Una dintre cerințele directivei prevedea că statele membre trebuie sprijinite de Comisie în dezvoltarea rețelelor europene de referință. Bugetul UE nu conține o linie bugetară specifică pentru costurile aferente rețelelor europene de referință. Pentru a veni în sprijinul operațiunilor rețelelor europene de referință, Comisia a furnizat finanțare din diferite programe de cheltuieli (Programul în domeniul sănătății, Mecanismul pentru interconectarea Europei) și prin intermediul diferitor mecanisme de cheltuieli (cereri de propuneri și proceduri de ofertare). Comisia nu a elaborat un plan de cheltuieli cuprinzător pentru perioada 2017‑2021 și nu a comunicat niciun astfel de plan rețelelor europene de referință sau autorității bugetare.
59În noiembrie 2017, Comisia a pus la dispoziția rețelelor sistemul CPMS, care permite partajarea și consultarea datelor pacienților (a se vedea punctul 15). Consultațiile pacienților efectuate prin intermediul acestui sistem constituie unul dintre aspectele semnificative ale operațiunilor desfășurate prin rețelele europene de referință. Utilizarea consultațiilor transfrontaliere prin intermediul CPMS a evidențiat însă problema recunoașterii timpului alocat de medici pentru stabilirea diagnosticului și pentru tratarea pacienților dintr-un alt stat membru. Figura 7 prezintă numărul comisiilor pentru consultații create în sistem pentru fiecare rețea europeană de referință între noiembrie 2017 și decembrie 2018.
Figura 7
Comisiile pentru consultații sunt un semn al funcționării rețelelor europene de referință

Sursa: Raportul Comisiei privind CPMS, decembrie 2018.
Fiecare coordonator de rețea europeană de referință primește în prezent 1 milion de euro, pe o perioadă de cinci ani, cu titlu de finanțare din partea UE42 pentru costurile administrative. Au existat adesea întârzieri în ceea ce privește plata finanțării administrative anuale a rețelelor europene de referință. Un sondaj efectuat de Comisie în rândul coordonatorilor rețelelor în ianuarie 2018, la care au răspuns 20 de rețele, a arătat că sustenabilitatea finanțării constituie una dintre primele două cele mai importante provocări cu care se confruntă rețelele43. 17 dintre cele 24 de rețele europene de referință au inclus identificarea altor surse de finanțare printre obiectivele lor sau printre strategiile lor de atenuare a riscurilor.
61Pe lângă această finanțare a costurilor administrative, Comisia a acordat rețelelor europene de referință granturi, cu scopul de a sprijini îndeplinirea obiectivelor acestora. Comisia a lansat proceduri de achiziții pentru conceperea unor activități de sprijinire a constituirii și a dezvoltării rețelelor europene de referință. La sfârșitul anului 2018, aceste proceduri acopereau:
- utilizarea soluțiilor de e-sănătate, mai exact a sistemului Clinical Patient Management System (5 milioane de euro alocați din partea Mecanismului pentru interconectarea Europei);
- dezvoltarea orientărilor pentru practica clinică – Clinical Practice Guidelines (în total 4 milioane de euro din partea Programului în domeniul sănătății);
- registrele rețelelor europene de referință (în total 2 milioane de euro pentru cinci rețele în 2018 din partea Programului în domeniul sănătății);
- organizarea de cursuri de formare și furnizarea de instrumente pentru coordonatorii rețelelor europene de referință (invitație de participare la proceduri de ofertare pentru societăți externe, cu o valoare estimată la: 400 000 de euro);
- furnizarea de servicii de secretariat Grupului de lucru al coordonatorilor rețelelor europene de referință (invitație de participare la proceduri de ofertare pentru societăți externe, cu o valoare estimată la: 380 000 de euro);
- dezvoltarea unor modele standard pentru documentele din cadrul rețelelor europene de referință (invitație de participare la proceduri de ofertare pentru societăți externe, cu o valoare estimată la: 100 000 de euro).
Coordonatorii rețelelor europene de referință consideră că participarea la numeroasele cereri de propuneri derulate de Comisie a impus o sarcină administrativă semnificativă. În plus, sustenabilitatea pe termen lung a registrelor rețelelor europene de referință, finanțate în prezent cu fonduri din cadrul Programului în domeniul sănătății, este neclară, în pofida riscului subliniat de Comisie, în comunicarea sa din 2008 privind bolile rare, cu privire la finanțarea pe bază de proiecte a acestor registre.
În pofida întârzierilor, Comisia lansează în prezent la nivelul UE o platformă pentru registrele privind bolile rare
63În comunicarea sa din 2008 privind bolile rare, Comisia a subliniat importanța unor baze de date și a unor registre care să permită efectuarea unor cercetări epidemiologice și clinice privind bolile rare. În continuare, Comisia a subliniat importanța asigurării unei sustenabilități pe termen lung a acestor sisteme. Răspunzând acestei provocări, DG JRC a început, în 2013, să dezvolte Platforma europeană pentru registrele privind bolile rare, cofinanțată prin Programul în domeniul sănătății44 și deschisă pentru toate registrele europene privind bolile rare. Platforma JRC își propune să abordeze problema fragmentării datelor cuprinse în registrele de pacienți care suferă de boli rare din toată Europa, prin promovarea unor standarde la nivelul UE pentru colectarea de date și prin furnizarea de instrumente de interoperabilitate pentru schimburile de date cu privire la bolile rare.
64Curtea a constatat că, în paralel cu platforma JRC, Comisia a finanțat un alt proiect, RD-Connect, din programul de finanțare a cercetării și inovării (Al șaptelea program-cadru), printre obiectivele căruia se număra crearea unui repertoriu de registre privind pacienții pentru cercetarea în domeniul bolilor rare. Ambele proiecte au un obiectiv similar, și anume acela de conectare a registrelor din UE pentru a facilita accesul cercetătorilor la datele privind bolile rare. În consecință, Comisia finanțează două proiecte ale căror realizări este posibil să se suprapună.
65La data auditului, platforma JRC urma să devină operațională în februarie 2019, după mai mult de doi ani de la data planificată inițial. Unul dintre motivele întârzierii a fost acela că, pentru dezvoltarea platformei JRC, a fost nevoie în același timp de transferul a două rețele existente45 către JRC, ceea ce a necesitat mai mult timp și mai multe resurse decât se anticipase. Curtea a constatat că programarea inițială și alocarea bugetară prevăzută inițial pentru platformă erau nerealiste. În plus, finanțarea pusă la dispoziție de DG SANTE pentru platforma JRC acoperă în prezent aproximativ 45 % din costurile activității, însă nu există nicio dispoziție prin care să se asigure sustenabilitatea financiară a platformei și nicio planificare care să garanteze că platforma va avea succes, în afară de un plan de diseminare întocmit în al patrulea trimestru din 2017.
Concluzii și recomandări
66Curtea a examinat modul în care Comisia a supravegheat transpunerea Directivei privind asistența medicală transfrontalieră în statele membre, precum și rezultatele obținute până în prezent cu privire la schimburile transfrontaliere de date medicale. Curtea a evaluat, de asemenea, acțiunile întreprinse de UE în domeniul politicii privind bolile rare. Curtea a urmărit să răspundă la următoarea întrebare de audit:
Acțiunile întreprinse de UE în materie de asistență medicală transfrontalieră generează beneficii pentru pacienți?
67Curtea concluzionează că, deși acțiunile întreprinse de UE în domeniul asistenței medicale transfrontaliere erau ambițioase și au consolidat colaborarea dintre statele membre, ele necesită o mai bună gestionare. La data desfășurării auditului Curții, impactul asupra pacienților era limitat. 68
Curtea a constatat că Comisia supraveghea în mod adecvat punerea în aplicare a directivei în statele membre (punctele 23-28), și sprijinea activitatea punctelor naționale de contact responsabile pentru informarea pacienților cu privire la asistența medicală transfrontalieră. Comisia a elaborat recent un set de instrumente practice pentru uzul punctelor naționale de contact. Cu toate acestea, pacienții din UE se confruntă în continuare cu provocări în ceea ce privește accesul la asistență medicală în străinătate și doar un număr mic de pacienți potențiali au cunoștință despre dreptul lor de a solicita asistență medicală transfrontalieră. Complexitatea căilor pe care pacienții le au la dispoziție pentru a beneficia de tratament în cadrul asistenței medicale transfrontaliere în temeiul Directivei privind asistența medicală transfrontalieră și în temeiul Regulamentului privind coordonarea sistemelor de securitate socială îngreunează furnizarea de informații clare pentru aceștia. Punctele naționale de contact oferă informații limitate cu privire la rețelele europene de referință pe site-urile lor (punctele 29-32).
Recomandarea 1 – Furnizarea de sprijin suplimentar pentru punctele naționale de contactComisia ar trebui:
- să sprijine, luând ca bază acțiuni anterioare, activitatea punctelor naționale de contact, inclusiv în ceea ce privește identificarea celor mai bune modalități de a comunica legăturile care există între căile disponibile în temeiul Directivei privind asistența medicală transfrontalieră și cele disponibile în temeiul Regulamentului privind coordonarea sistemelor de securitate socială;
- să pună la dispoziție orientări cu privire la modul de prezentare a informațiilor legate de rețelele europene de referință pe site-urile punctelor naționale de contact;
- să urmărească utilizarea de către punctele naționale de contact a setului de instrumente din 2018.
Data-țintă pentru punerea în aplicare a recomandării: 2020
69În 2018, Comisia a adoptat o nouă strategie în domeniul e-sănătății fără să actualizeze actualul Plan de acțiune privind e-sănătatea. Strategia din 2018 în domeniul e-sănătății nu include un plan de punere în aplicare care să conțină un angajament privind respectarea unor termene precise pentru obținerea rezultatelor și a realizărilor preconizate (punctele 34-37).
70Activitățile desfășurate în scopul schimburilor transfrontaliere de date medicale au dus la crearea unor standarde de interoperabilitate. Comisia, în cooperare cu statele membre, construiește o infrastructură la nivelul UE pentru aceste schimburi. Comisia nu a estimat numărul probabil de utilizatori ai infrastructurii de e-sănătate la nivelul UE înainte de a lansa proiectul. Previziunile Comisiei privind gradul probabil de utilizare a schimburilor transfrontaliere de date medicale au fost excesiv de optimiste. S-au înregistrat întârzieri în implementarea infrastructurii de e-sănătate și, până la data desfășurării auditului Curții, schimburile transfrontaliere de date medicale prin intermediul acestei infrastructuri nu începuseră (punctele 38-47).
Recomandarea 2 – O mai bună pregătire pentru schimburile transfrontaliere de date medicaleComisia ar trebui:
- să evalueze rezultatele obținute pentru schimburile transfrontaliere de date medicale prin intermediul infrastructurii de e-sănătate la nivelul UE (pentru prescripțiile electronice și pentru dosarele medicale electronice ale pacienților);
- să evalueze, ținând seama de acest aspect, Planul de acțiune din 2012 privind e-sănătatea și punerea în aplicare a Strategiei din 2018 în domeniul e-sănătății, inclusiv gradul în care aceste acțiuni au oferit, în timp util, soluții cu un raport optim costuri-eficacitate și gradul în care au adus o contribuție semnificativă la sistemele de sănătate naționale.
Data-țintă pentru punerea în aplicare a recomandării: 2021
Data-țintă pentru punerea în aplicare a recomandării: 2021
Lansarea rețelelor europene de referință reprezintă o inovație ambițioasă pentru cooperarea în cadrul asistenței medicale transfrontaliere, mai ales ținând cont de faptul că sectorul sănătății ține de competența statelor membre. Comisia a pus la dispoziția rețelelor europene de referință înființate sistemul de gestionare a pacienților clinici (Clinical Patient Management System) pentru a facilita schimbul de date ale pacienților. Rețelele europene de referință au fost înființate în martie 2017, astfel încât este prea devreme ca succesul lor să poată fi evaluat sub aspectul valorii lor adăugate la eforturile depuse de statele membre în vederea furnizării unor îngrijiri medicale mai bune pentru pacienții care suferă de boli rare.
72Curtea a constatat că, din 2014, Comisia nu a făcut niciun bilanț al progreselor realizate în punerea în aplicare a strategiei UE în domeniul bolilor rare (punctele 49-51). Procesul de înființare a rețelelor europene de referință și sprijinul permanent acordat acestora de către Comisie erau afectate de unele deficiențe și Comisia nu a stabilit un plan de cheltuieli pentru rețelele europene de referință. Rețelele europene de referință se confruntă cu provocări semnificative în privința asigurării sustenabilității lor financiare și a capacității lor de a funcționa în mod eficace în cadrul sistemelor de sănătate naționale și între aceste sisteme. Prin urmare, Comisia a încurajat statele membre să integreze rețelele europene de referință în sistemele de sănătate naționale (punctele 52-62). Curtea a constatat, de asemenea, că s-au înregistrat întârzieri în ceea ce privește lansarea la nivelul UE a platformei pentru registrele privind bolile rare (punctele 63-65).
Recomandarea 3 – Îmbunătățirea sprijinului menit să faciliteze accesul pacienților care suferă de boli rare la asistență medicalăComisia ar trebui:
- să evalueze rezultatele strategiei privind bolile rare (inclusiv rolul rețelelor europene de referință) și să decidă dacă această strategie trebuie actualizată, adaptată sau înlocuită;
- să stabilească, în consultare cu statele membre, căile de urmat pentru a aborda provocările cu care se confruntă rețelele europene de referință (inclusiv integrarea rețelelor europene de referință în sistemele de sănătate naționale și registrele privind pacienții);
- să urmărească simplificarea structurii oricărei finanțări viitoare din partea UE pentru rețelele europene de referință și să reducă sarcina administrativă a acestora.
Data-țintă pentru punerea în aplicare a recomandării: 2023
Data-țintă pentru punerea în aplicare a recomandării: 2020
Data-țintă pentru punerea în aplicare a recomandării: 2022
Prezentul raport a fost adoptat de Camera I, condusă de domnul Nikolaos MILIONIS, membru al Curții de Conturi, la Luxemburg, în ședința sa din 10 aprilie 2019.
Pentru Curtea de Conturi

Klaus-Heiner LEHNE
Președinte
Anexe
Anexa I – Comparație între drepturile pacienților la asistență medicală transfrontalieră în temeiul directivei și în temeiul regulamentului
| DIRECTIVĂ | REGULAMENT | |
|---|---|---|
| Sector | Public + Privat | Doar public |
| Tratamente eligibile | Tratamentele disponibile în cadrul sistemului de asigurări de sănătate din țara de afiliere a pacienților | Tratamentele disponibile în cadrul sistemului de asigurări de sănătate din țara de tratament |
| Autorizare prealabilă | Necesară în anumite circumstanțe | Întotdeauna necesară în cazul asistenței medicale planificate Nu este necesară în situații de urgență |
| Costuri acoperite | Rambursare până la nivelul costurilor care ar fi fost acoperite în cazul în care tratamentul ar fi fost acordat în țara de afiliere a pacienților | Finanțare integrală (cu excepția coplății) |
| Rambursarea coplății | Până la nivelul costurilor suportate în țara de afiliere | Da (în anumite condiții) |
| Modalitatea de plată | Pacienții plătesc în avans și sunt rambursați ulterior (sistem bazat pe rambursare) | Între țări, pacienții nu trebuie să plătească în avans (sistem bazat pe finanțare) |
| Țările eligibile | Toate țările din UE și din SEE | Toate țările din UE și din SEE + Elveția |
Sursa: Curtea de Conturi Europeană, pe baza site-ului site-ului Healthcare Beyond Borders.
Anexa II – Stadiul actual al implementării planificate pentru schimburile transfrontaliere de date medicale în UE

Sursa: Service Catalogue, Delivery and Overall Deployment – eHDSI – ePrescription and Patient Summary, disponibil pe site-ul eHDSI46.
Anexa III – Lista rețelelor europene de referință
| Denumirea abreviată a rețelei europene de referință | Denumirea completă a rețelei europene de referință |
|---|---|
| Endo-ERN | Rețeaua europeană de referință privind bolile endocrine |
| ERKNet | Rețeaua europeană de referință privind afecțiunile renale |
| ERN BOND | Rețeaua europeană de referință privind bolile osoase rare |
| ERN CRANIO | Rețeaua europeană de referință privind anomaliile cranio-faciale și tulburările ORL |
| EpiCARE | Rețeaua europeană de referință privind formele rare și complexe de epilepsie |
| ERN EURACAN | Rețeaua europeană de referință privind cancerul la adulți (tumori solide) |
| EuroBloodNet | Rețeaua europeană de referință privind afecțiunile hematologice rare |
| ERN eUROGEN | Rețeaua europeană de referință privind bolile și afecțiunile urogenitale |
| ERN EURO-NMD | Rețeaua europeană de referință privind afecțiunile neuromusculare |
| ERN EYE | Rețeaua europeană de referință privind bolile oculare |
| ERN Genturis | Rețeaua europeană de referință privind sindroamele de tumori genetice |
| ERN Guard-Heart | Rețeaua europeană de referință privind bolile cardiace |
| ERN ERNICA | Rețeaua europeană de referință privind anomaliile moștenite și congenitale |
| ERN ITHACA | Rețeaua europeană de referință privind malformațiile congenitale și formele rare de retardare mintală |
| ERN LUNG | Rețeaua europeană de referință privind afecțiunile respiratorii |
| ERN TRANSPLANT-CHILD | Rețeaua europeană de referință privind transplanturile la copii |
| ERN PaedCan | Rețeaua europeană de referință privind cancerul la copii (hemato-oncologie) |
| ERN RARE-LIVER | Rețeaua europeană de referință privind bolile hepatice |
| ERN ReCONNET | Rețeaua europeană de referință privind bolile țesutului conjunctiv și afecțiunile musculo-scheletice |
| ERN RITA | Rețeaua europeană de referință privind imunodeficiența, bolile autoinflamatorii și bolile autoimune |
| ERN-RND | Rețeaua europeană de referință privind afecțiunile neurologice |
| ERN Skin | Rețeaua europeană de referință privind bolile de piele |
| MetabERN | Rețeaua europeană de referință privind tulburările ereditare de metabolism |
| VASCERN | Rețeaua europeană de referință privind afecțiunile multisistemice rare ale sistemului vascular |
Acronime și abrevieri
CPMS: Sistemul de gestionare a pacienților clinici (Clinical Patient Management System)
DG SANTE: Direcția Generală Sănătate și Siguranță Alimentară
eHDSI: infrastructura de servicii digitale de e-sănătate
eHMSEG: Grupul de experți din statele membre pentru eHDSI
epSOS: Servicii deschise inteligente pentru pacienții europeni (Smart Open Service for European Patients)
EUCERD: Comitetul de experți al Uniunii Europene privind bolile rare
JRC: Centrul Comun de Cercetare din cadrul Comisiei Europene
MIE: Mecanismul pentru interconectarea Europei
NCPeH: punct național de contact pentru e-sănătate
REN: rețea europeană de referință
TFUE: Tratatul privind funcționarea Uniunii Europene
Glosar
Asistență medicală transfrontalieră: asistență medicală furnizată sau prescrisă în afara țării de afiliere a persoanei asigurate.
Boală rară: o boală sau o afecțiune este definită ca fiind rară în UE atunci când ajunge la un prag de răspândire de cel mult 5 persoane afectate din 10 000.
Coordonator de rețea europeană de referință: pentru fiecare rețea, unul dintre membrii acesteia are rolul de coordonator. Coordonatorii facilitează cooperarea între membrii rețelei.
Dosar electronic de sănătate (DES): un dosar medical complet sau o documentație similară privind starea de sănătate fizică și psihică din trecut și din prezent a unei persoane, în format electronic, care oferă acces rapid la aceste date în scopul unui tratament medical sau în alte scopuri strâns legate între ele.
e-sănătate: utilizarea tehnologiilor informației și comunicațiilor pentru produsele, serviciile și procesele din domeniul sănătății, în combinație cu schimbări organizaționale în sistemele de sănătate și cu noi aptitudini. E-sănătatea reprezintă transferul de asistență medicală prin mijloace electronice.
Interoperabilitatea: capacitatea de a utiliza și de a face schimb de date între diferitele sisteme de sănătate pentru a interconecta informații.
Prescripție electronică: o prescripție pentru unul sau mai multe medicamente ori pentru unul sau mai multe tratamente, eliberată în format electronic cu ajutorul unor programe informatice de către un cadru medical autorizat în mod legal, precum și transmiterea electronică a datelor prescripției către o farmacie în care produsele farmaceutice pot fi ulterior eliberate.
Rețele europene de referință: rețele virtuale la care participă furnizori de servicii medicale din toată Europa. Scopul lor este acela de a aborda bolile și condițiile rare sau complexe care necesită tratament foarte specializat și o concentrare de cunoștințe și de resurse.
Note
1 Directiva 2011/24/UE a Parlamentului European și a Consiliului din 9 martie 2011 privind aplicarea drepturilor pacienților în cadrul asistenței medicale transfrontaliere (JO L 88, 4.4.2011, p. 45).
2 Articolul 168 din Tratatul privind funcționarea Uniunii Europene (TFUE).
3 Regulamentul (CE) nr. 883/2004 al Parlamentului European și al Consiliului din 29 aprilie 2004 privind coordonarea sistemelor de securitate socială (JO L 166, 30.4.2004, p. 1). Acest regulament prezintă relevanță pentru asistența medicală transfrontalieră în contextul mobilității forței de muncă și al turismului și sub aspectul legăturilor acestor două domenii cu asistența medicală și cu sistemele de securitate socială.
4 Potrivit rezultatelor obținute în urma sondajului realizat în rândul punctelor naționale de contact de către Grupul de experți în domeniul asistenței medicale transfrontaliere (Cross-border Healthcare Expert Group) în mai 2017 și confirmate de sondajul efectuat de Curte în rândul membrilor acestui grup.
5 Raport al Comisiei cu privire la punerea în aplicare a Directivei 2011/24/UE privind aplicarea drepturilor pacienților în cadrul asistenței medicale transfrontaliere, COM(2018) 651 final.
6 Anexa B la Raportul Comisiei cu privire la punerea în aplicare a Directivei 2011/24/UE, COM(2018) 651 final .
7 Cooperarea teritorială europeană, cunoscută mai mult sub denumirea „Interreg”, este unul dintre cele două obiective ale politicii de coeziune a UE și oferă un cadru pentru acțiuni comune și pentru schimburi în materie de politici între părțile interesate de la nivel național, regional și local din diferite state membre.
8 Study on Cross-Border Cooperation. Capitalising on existing initiatives for cooperation in cross-border regions (Studiu privind cooperarea transfrontalieră – Valorificarea inițiativelor existente pentru cooperarea în regiunile transfrontaliere) – studiu al Comisiei publicat în martie 2018. Lista proiectelor și a obiectivelor acestora, astfel cum au fost identificate de studiu, poate fi accesată online aici.
9 Comunicarea Comisiei privind modalitățile de a face posibilă transformarea digitală a serviciilor de sănătate și de asistență în cadrul pieței unice digitale, autonomizarea cetățenilor și construirea unei societăți mai sănătoase, 25 aprilie 2018, COM(2018) 233 final . Comunicarea a rezultat din evaluarea la jumătatea perioadei a strategiei privind piața unică digitală.
10 Belgia, Republica Cehă, Germania, Estonia, Irlanda, Grecia, Spania, Franța, Croația, Italia, Cipru, Lituania, Luxemburg, Ungaria, Malta, Țările de Jos, Austria, Polonia, Portugalia, Slovenia, Finlanda și Suedia.
11 Zece state membre au raportat că gradul de acoperire națională a prescripțiilor electronice era de peste 90 % în 2017 (Croația, Republica Cehă, Danemarca, Estonia, Finlanda, Grecia, Italia, Portugalia, Spania și Suedia).
12 epSOS – Smart Open Service for European Patients – proiect finanțat în cadrul temei 3 din cadrul Programului pentru competitivitate și inovare: Servicii de sănătate viabile și interoperabile.
13 Recomandarea Consiliului din 8 iunie 2009 privind o acțiune în domeniul bolilor rare.
14 Comitetul statelor membre pentru rețelele europene de referință a fost creat prin Decizia 2014/287/UE de punere în aplicare a Comisiei din 10 martie 2014 de stabilire a criteriilor pentru înființarea și evaluarea rețelelor europene de referință și a membrilor lor și pentru facilitarea schimbului de informații și de expertiză privind înființarea și evaluarea unor asemenea rețele (JO L 147, 17.5.2014, p. 79).
15 Strategia Curții de Conturi Europene pentru perioada 2018‑2020.
16 Danemarca, Italia, Lituania, Țările de Jos și Suedia.
17 Directiva de punere în aplicare 2012/52/UE a Comisiei din 20 decembrie 2012 de stabilire a unor măsuri pentru facilitarea recunoașterii prescripțiilor medicale emise în alt stat membru (JO L 356, 22.12.2012, p. 68).
18 Articolul 20 din directivă.
19 Printre aceste studii s-au numărat: studiul din 2012 privind abordarea bazată pe cele mai bune practici pentru site-urile punctelor naționale de contact, cu recomandări adresate statelor membre și Comisiei referitor la modalitățile de a furniza informații adecvate cu privire la diverse aspecte esențiale ale asistenței medicale transfrontaliere prin intermediul punctelor naționale de contact (A best practice based approach to National Contact Point websites: feasibility study); studiul din 2014 privind impactul informațiilor asupra opțiunilor pe care le au la dispoziție pacienții în contextul directivei (Impact of information on patients' choice within the context of the Directive 2011/24/EU); studiul de evaluare din 2015 privind aplicarea directivei, care conține, printre altele, o analiză a site-urilor punctelor naționale de contact (Evaluative study on the cross-border healthcare Directive (2011/24/EU)).
20 Conform unui studiu realizat de Comisie în rândul punctelor naționale de contact în scopul raportului acesteia privind aplicarea directivei.
21 Study on cross-border health services: enhancing information provision to patients (Studiu privind serviciile de asistență medicală transfrontalieră: îmbunătățirea informării pacienților), studiu publicat la 20 iulie 2018.
22 Raport referitor la punerea în aplicare a Directivei privind asistența medicală transfrontalieră, 29 ianuarie 2019, Comisia pentru mediu, sănătate publică și siguranță alimentară.
23 Raportul reuniunii punctelor naționale de contact din 5 mai 2017.
24 Comunicarea Comisiei privind modalitățile de a face posibilă transformarea digitală a serviciilor de sănătate și de asistență în cadrul pieței unice digitale, autonomizarea cetățenilor și construirea unei societăți mai sănătoase, 25 aprilie 2018, COM(2018) 233 final. Comunicarea a rezultat din evaluarea la jumătatea perioadei a strategiei privind piața unică digitală.
25 Interim evaluation of the eHealth Action Plan 2012‑2020, studiu elaborat de Deloitte pentru Comisie.
26 Bugetul total al proiectului a fost de 38 de milioane de euro, din care s-a convenit ca UE să cofinanțeze suma de 18 milioane de euro. În total, 24 de țări au participat la proiect.
27 Suma include servicii informatice pentru rețelele europene de referință.
28 Raportul final de evaluare tehnică a epSOS, 12 noiembrie 2014.
29 În 2014, Unitatea pentru Sisteme Informaționale din cadrul DG SANTE a efectuat o evaluare a proiectului epSOS, pentru a obține o imagine de ansamblu asupra realizărilor și asupra rezultatelor proiectului și pentru a rezuma concluziile cu privire la maturitatea proiectului în vederea unei posibile implementări ulterioare la scară largă.
30 Site-ul web al Comisiei: Cross-border digital prescription and patient data exchange are taking off (Prescripțiile digitale și schimburile de date ale pacienților la nivel transfrontalier încep să se dezvolte).
31 Site-ul web al Comisiei: eHDSI governance (Guvernanța eHDSI).
32 Annex of the 2016 Annual Activity Report (AAR) – Health and Food Safety (Anexa la Raportul anual de activitate pe 2016 – Sănătate și Siguranță Alimentară). În Raportul său anual de activitate pe 2017, Comisia a raportat nouă state membre, întrucât Danemarca și-a retras participarea la serviciile informaționale de e-sănătate transfrontaliere (a se vedea punctul 10 și caseta 1).
33 Republica Cehă, Estonia, Croația, Luxemburg, Malta, Portugalia și Finlanda.
34 Comunicarea Comisiei: „Bolile rare: o provocare pentru Europa”, COM(2008) 679 final.
35 Recomandarea Consiliului din 8 iunie 2009 privind o acțiune în domeniul bolilor rare.
36 Comitetul de experți al Uniunii Europene privind bolile rare (EUCERD) instituit prin Decizia Comisiei Europene din 30 noiembrie 2009 (2009/872/CE).
37 Comisia a elaborat cadrul pentru această acțiune în decizia de punere în aplicare și în decizia delegată, ambele din 10 martie 2014.
38 Raportul anual de activitate pe 2016 al DG SANTE (anexa A, p. 169) indică un obiectiv intermediar de 10 rețele europene de referință în cadrul indicatorului de rezultat 1.5.A: numărul de rețele europene de referință înființate.
39 Articolul 4 alineatul (5) din Decizia de punere în aplicare a Comisiei 2014/287/UE.
40 În cadrul eșantionului său, format din 50 de rapoarte de evaluare a furnizorilor de servicii medicale pentru 23 de rețele europene de referință, Curtea a constatat că 30 de furnizori de servicii medicale nu au oferit informații cu privire la un plan de acțiune clar.
41 Articolul 14 din Decizia de punere în aplicare a Comisiei 2014/287/UE din 10 martie 2014.
42 Al treilea program în domeniul sănătății.
43 Comitetul statelor membre pentru rețelele europene de referință, 6 martie 2018.
44 Pe baza acordului administrativ dintre DG SANTE și JRC.
45 EUROCAT (European Surveillance of Congenital Anomalies – Monitorizarea europeană a anomaliilor congenitale) și SCPE (Surveillance of Cerebral Palsy in Europe – Autoritatea de Supraveghere a Paraliziei Cerebrale în Europa).
46 În noiembrie 2018, rețeaua de e-sănătate a aprobat cererile a patru state membre de a deveni operaționale în cadrul schimburilor transfrontaliere de date medicale prin intermediul eHDSI: Finlanda poate trimite prescripții electronice, în timp ce Estonia le poate primi. Republica Cehă și Luxemburg sunt în prezent autorizate să primească dosare electronice ale pacienților din străinătate, însă niciun stat membru nu poate încă trimite astfel de dosare prin intermediul eHDSI. Trei state membre (Croația, Malta și Portugalia) intenționează să solicite aprobarea de a deveni operaționale în primul trimestru al anului 2019.
47 Fiecare stat membru care participă la eHDSI a primit finanțare prin programul de telecomunicații al MIE în scopul înființării unui punct de contact național pentru e-sănătate și al inițierii schimbului transfrontalier de date medicale. Calendarul punerii în aplicare la nivel național face parte dintr-un acord de grant semnat de fiecare stat membru cu Comisia.
48 Cele patru țări autorizate să participe la rețeaua de e-sănătate în noiembrie 2018 intenționează să introducă mai multe servicii (trimiterea și primirea de prescripții electronice sunt două servicii diferite). (i) Finlanda a început să trimită prescripții electronice și intenționează ca, până la sfârșitul anului 2019, să înceapă să primească astfel de prescripții. (ii) Estonia a început să primească prescripții electronice și intenționează să înceapă să trimită astfel de prescripții până la sfârșitul anului 2019. (iii) Republica Cehă este pregătită atât să trimită, cât și să primească dosare ale pacienților și intenționează ca, până la sfârșitul anului 2020, să înceapă să trimită și să primească prescripții electronice. (iv) Luxemburgul este pregătit să primească dosare ale pacienților și intenționează ca, până la sfârșitul anului 2019, să înceapă să trimită astfel de dosare. De asemenea, Luxemburgul intenționează să înceapă să trimită prescripții electronice până la sfârșitul anului 2020.
La 11 martie, Croația a primit din partea Grupului de experți din statele membre pentru eHDSI (eHMSEG) o recomandare pozitivă privind participarea sa la schimbul de prescripții electronice (în ceea ce privește atât trimiterea, cât și primirea acestora) și de dosare ale pacienților (primirea acestora), de îndată ce auditorii vor confirma că ultima acțiune corectivă în curs de realizare a fost pusă în aplicare cu succes. Pentru a deveni efectivă, această recomandare trebuie să fie adoptată de rețeaua de e-sănătate.
49 http://eur-lex.europa.eu/legal-content/RO/TXT/HTML/?uri=CELEX:12012E/TXT&from=EN
50 Mai precis: 1) Concluziile proiectului-pilot „Rare 2030”, finanțat de Parlamentul European, urmăresc să sprijine deciziile politice viitoare, să examineze fezabilitatea unor noi abordări și să propună recomandări politice (rezultatele sunt așteptate la începutul anului 2021); 2) evaluarea celui de-al treilea program în domeniul sănătății (prevăzută să aibă loc la jumătatea anului 2021); 3) evaluarea Directivei 2011/24/UE privind aplicarea drepturilor pacienților în cadrul asistenței medicale transfrontaliere (prevăzută să aibă loc la sfârșitul anului 2022); 4) evaluarea Programului-cadru pentru cercetare și inovare „Orizont 2020” (data preconizată urmează să fie confirmată).
51 https://ec.europa.eu/health/sites/health/files/cross_border_care/docs/2018_crossborder_frep_en.pdf
Echipa de audit
Rapoartele speciale ale Curții de Conturi Europene prezintă rezultatele auditurilor sale cu privire la politicile și programele UE sau la diverse aspecte legate de gestiune aferente unor domenii specifice ale bugetului UE. Curtea selectează și concepe aceste sarcini de audit astfel încât impactul lor să fie maxim, luând în considerare riscurile existente la adresa performanței sau a conformității, nivelul de venituri sau de cheltuieli implicat, schimbările preconizate și interesul existent în mediul politic și în rândul publicului larg.
Acest audit al performanței a fost efectuat de Camera de audit I – Utilizarea durabilă a resurselor naturale, condusă de domnul Nikolaos Milionis, membru al Curții de Conturi Europene. Auditul a fost condus de domnul Janusz Wojciechowski, membru al Curții de Conturi Europene, beneficiind de sprijinul unei echipe formate din: Kinga Wiśniewska-Danek, șefă de cabinet, și Katarzyna Radecka-Moroz, atașat în cadrul cabinetului; Colm Friel, manager principal; Joanna Kokot, coordonatoare; Nicholas Edwards, coordonator adjunct și Frédéric Soblet, Aris Konstantinidis, Anna Zalega, Michela Lanzutti, Jolanta Zemailaite, auditori. Mark Smith a asigurat asistența lingvistică.

De la stânga la dreapta: Frédéric Soblet, Kinga Wiśniewska-Danek, Aris Konstantinidis, Janusz Wojciechowski, Colm Friel, Joanna Kokot, Nicholas Edwards, Jolanta Zemailaite.
Contact
CURTEA DE CONTURI EUROPEANĂ
12, rue Alcide de Gasperi
1615 Luxembourg
LUXEMBOURG
Tel. +352 4398-1
Întrebări: eca.europa.eu/ro/Pages/ContactForm.aspx
Website: eca.europa.eu
Twitter: @EUAuditors
Numeroase alte informații despre Uniunea Europeană sunt disponibile pe internet pe serverul Europa (http://europa.eu).
Luxemburg: Oficiul pentru Publicații al Uniunii Europene, 2019
| ISBN 978-92-847-1943-3 | ISSN 1977-5806 | doi:10.2865/658840 | QJ-AB-19-005-RO-N | |
| HTML | ISBN 978-92-847-1916-7 | ISSN 1977-5806 | doi:10.2865/852780 | QJ-AB-19-005-RO-Q |
© Uniunea Europeană, 2019
Reproducerea textului este autorizată cu condiția menționării sursei. Pentru utilizarea sau reproducerea în orice fel a unor fotografii sau a altor materiale pentru care Uniunea Europeană nu deține drepturile de autor, trebuie să se solicite acordul direct de la deținătorii drepturilor de autor.
CONTACTAȚI UE
În persoană
În întreaga Uniune Europeană există sute de centre de informare Europe Direct. Puteți găsi adresa centrului cel mai apropiat de dumneavoastră la: https://europa.eu/european-union/contact_ro
La telefon sau prin e-mail
Europe Direct este un serviciu care vă oferă răspunsuri la întrebările privind Uniunea Europeană. Puteți accesa acest serviciu:
- apelând numărul gratuit 00 800 6 7 8 9 10 11 (unii operatori pot taxa aceste apeluri);
- apelând numărul standard: +32 22999696; sau
- prin e-mail, la: https://europa.eu/european-union/contact_ro
GĂSIȚI INFORMAȚII DESPRE UE
Online
Informații despre Uniunea Europeană în toate limbile oficiale ale UE sunt disponibile pe site-ul Europa, la: https://europa.eu/european-union/contact_ro
Publicații ale UE
Puteți descărca sau comanda publicații ale UE gratuite și contra cost pe site-ul EU Bookshop, la: https://op.europa.eu/ro/publications. Mai multe exemplare ale publicațiilor gratuite pot fi obținute contactând Europe Direct sau centrul dumneavoastră local de informare (a se vedea https://europa.eu/european-union/contact_ro).
Dreptul UE și documente conexe
Pentru accesul la informații juridice din UE, inclusiv la ansamblul legislației UE începând din 1951 în toate versiunile lingvistice oficiale, accesați site-ul EUR-Lex, la: http://eur-lex.europa.eu/homepage.html?locale=ro
Datele deschise ale UE
Portalul de date deschise al UE (http://data.europa.eu/euodp/ro/home?) oferă acces la seturi de date din UE. Datele pot fi descărcate și reutilizate gratuit, atât în scopuri comerciale, cât și necomerciale.
 Raportul special
Raportul special