
Działania UE w zakresie transgranicznej opieki zdrowotnej – ustanowiono ambitne cele, lecz konieczne jest usprawnienie zarządzania
(przedstawione na mocy art. 287 ust. 4 akapit drugi TFUE)
Informacje na temat niniejszego sprawozdania Dyrektywa z 2011 r. w sprawie transgranicznej opieki zdrowotnej ma zagwarantować pacjentom prawo dostępu do bezpiecznej opieki zdrowotnej dobrej jakości, w tym opieki świadczonej transgranicznie w obrębie UE. Przepisy te mają również ułatwić ściślejszą współpracę między państwami członkowskimi w zakresie e-zdrowia i leczenia rzadkich chorób. Trybunał ustalił, że wprawdzie działania UE w zakresie transgranicznej opieki zdrowotnej usprawniły współpracę między państwami członkowskimi, lecz przyniosły pacjentom jedynie ograniczone korzyści. Trybunał stwierdził, że pomimo postępów w zapewnianiu obywatelom UE informacji na temat transgranicznej opieki zdrowotnej w niektórych obszarach dostęp do informacji pozostaje utrudniony. Trybunał wskazał ponadto uchybienia w planowaniu strategicznym i zarządzaniu projektami przez Komisję. W sprawozdaniu przedstawiono zalecenia dotyczące w szczególności wsparcia Komisji na rzecz krajowych punktów kontaktowych, wdrożenia transgranicznej wymiany danych dotyczących zdrowia oraz działań UE w dziedzinie rzadkich chorób.
Streszczenie
IWprawdzie transgraniczna opieka zdrowotna ma wciąż bardzo niewielkie znaczenie w porównaniu z usługami opieki zdrowotnej świadczonymi w granicach krajowych, lecz w niektórych sytuacjach najlepsze i najłatwiej dostępne dla pacjentów leczenie można zapewnić w innym państwie członkowskim niż państwo pochodzenia pacjenta. Dzięki temu, że pacjent może podjąć swobodną i świadomą decyzję, by skorzystać z transgranicznej opieki zdrowotnej, można poprawić jakość świadczeń zdrowotnych, których jest odbiorcą.
IICelem dyrektywy z 2011 r. w sprawie transgranicznej opieki zdrowotnej jest zagwarantowanie pacjentom prawa dostępu do bezpiecznych usług opieki zdrowotnej dobrej jakości świadczonych transgranicznie w obrębie UE, a także prawa do zwrotu kosztów za takie usługi. Dyrektywa ułatwia zacieśnienie współpracy w szeregu obszarów, zwłaszcza w zakresie transgranicznej wymiany danych dotyczących pacjentów oraz dostępu do opieki zdrowotnej dla pacjentów cierpiących na rzadkie choroby.
IIIRocznie ok. 200 000 pacjentów, tj. mniej niż 0,05% obywateli UE, korzysta z systemów ustanowionych na mocy dyrektywy, by poddać się leczeniu zagranicą. W ostatnich latach największą liczbę pacjentów, którzy leczyli się za granicą, odnotowano we Francji, największą liczbę przyjętych pacjentów zagranicznych natomiast – w Hiszpanii. Mobilność pacjentów w największym stopniu dotyczy sąsiadujących państw członkowskich.
IVTrybunał zbadał, czy Komisja zapewniła odpowiedni nadzór nad wdrożeniem dyrektywy w państwach członkowskich oraz wytyczne dla krajowych punktów kontaktowych odpowiedzialnych za informowanie pacjentów o przysługującym im prawie do transgranicznej opieki zdrowotnej. Ocenił, czy rezultaty osiągnięte w odniesieniu do transgranicznej wymiany danych dotyczących pacjentów były zgodne z oczekiwaniami i przyniosły pacjentom korzyści. Trybunał przeanalizował również najistotniejsze niedawne działania UE w dziedzinie rzadkich chorób, ze szczególnym uwzględnieniem utworzenia europejskich sieci referencyjnych. Sieci te mają umożliwić dzielenie się wiedzą, zapewnić doradztwo w zakresie diagnostyki i leczenia dzięki internetowym konsultacjom między świadczeniodawcami w Europie i tym samym doprowadzić do podniesienia standardów opieki.
VTrybunał stwierdził, że choć działania UE w zakresie transgranicznej opieki zdrowotnej usprawniły współpracę między państwami członkowskimi, w momencie prowadzenia kontroli oddziaływanie tych działań na pacjentów pozostawało ograniczone. Działania te mają ambitne cele oraz wymagają lepszego zarządzania.
VIKomisja zapewniła odpowiedni nadzór nad wdrożeniem dyrektywy w sprawie transgranicznej opieki zdrowotnej. Przedstawiła krajowym punktom kontaktowym wytyczne na rzecz lepszego informowania o transgranicznej opiece zdrowotnej, niemniej pewne aspekty wymagają jeszcze poprawy.
VIIDo czasu przeprowadzenia kontroli nie dokonano żadnej transgranicznej wymiany danych dotyczących pacjentów między państwami członkowskimi i nie udało się w związku z tym wykazać żadnych korzyści dla pacjentów wynikających z takiej wymiany. Komisja nie opracowała planu wdrażania zawierającego harmonogram dla swojej nowej strategii w dziedzinie e-zdrowia i nie oszacowała liczby potencjalnych użytkowników przed uruchomieniem transgranicznej wymiany danych dotyczących zdrowia.
VIIIKoncepcja europejskich sieci referencyjnych do spraw rzadkich chorób znajduje szerokie poparcie wśród zainteresowanych stron w UE (organizacji pacjentów, lekarzy i świadczeniodawców opieki zdrowotnej). Niemniej Komisja nie przedstawiła jasnych perspektyw dotyczących przyszłego finansowania ani tego, w jaki sposób należy rozwijać te sieci i włączać je do krajowych systemów opieki zdrowotnej.
IXW oparciu o sformułowane wnioski Trybunał przedstawia zalecenia dotyczące w szczególności wsparcia Komisji na rzecz krajowych punktów kontaktowych, wdrożenia transgranicznej wymiany danych dotyczących zdrowia oraz działań UE w dziedzinie rzadkich chorób.
Wstęp
01Dyrektywa w sprawie transgranicznej opieki zdrowotnej (zwana dalej „dyrektywą”)1:
- przyznaje pacjentom prawo dostępu w UE do bezpiecznych usług opieki zdrowotnej dobrej jakości świadczonych transgranicznie w obrębie UE, a także prawo do zwrotu kosztów za takie usługi;
- przewiduje ustanowienie krajowych punktów kontaktowych mających zapewnić obywatelom informacje na temat praw do transgranicznej opieki zdrowotnej;
- ma ułatwić ściślejszą współpracę w dziedzinie e-zdrowia, w tym transgraniczną wymianę danych dotyczących pacjentów;
- ma ułatwić pacjentom dostęp do opieki zdrowotnej dotyczącej rzadkich chorób, w szczególności przez rozwój europejskich sieci referencyjnych.
Prawa pacjentów do transgranicznej opieki zdrowotnej
02Opieka zdrowotna należy do kompetencji krajowych. Państwa członkowskie finansują i organizują własne systemy opieki zdrowotnej oraz zarządzają nimi2. W dyrektywie określono warunki, na których pacjent może udać się do innego państwa UE na zaplanowane leczenie. Zwrot kosztów za to leczenie odbywa się na takich samych warunkach jak w państwie członkowskim pacjenta. Przepisy obejmują kwestię kosztów opieki zdrowotnej oraz zapisywania i podawania leków i wyrobów medycznych. Uzupełniają ramy prawne ustanowione wcześniej na mocy unijnego rozporządzenia w sprawie koordynacji systemów zabezpieczenia społecznego3 (w załączniku I zamieszczono porównanie praw przysługujących pacjentom na mocy dyrektywy i rozporządzenia). Dyrektywa ma na celu ułatwienie dostępu do bezpiecznej transgranicznej opieki zdrowotnej dobrej jakości w oparciu o swobodny i świadomy wybór pacjenta, ponieważ w niektórych przypadkach najlepsze lub najłatwiej dostępne dla pacjentów leczenie można zapewnić wyłącznie w państwie członkowskim innym niż państwo pochodzenia pacjenta. Niemniej dyrektywa nie zachęca pacjentów do korzystania ze świadczeń zdrowotnych za granicą.
03Pacjenci, którzy chcieliby skorzystać z opieki zdrowotnej w innym państwie członkowskim, są uprawnieni do otrzymania istotnych informacji na temat standardów leczenia i opieki, zasad zwrotu kosztów oraz najlepszej dostępnej ścieżki prawnej. Informacje te powinien zainteresowanym zapewnić każdy krajowy punkt kontaktowy. Państwa członkowskie mogą wymagać uprzedniej zgody w odniesieniu do określonych świadczeń opieki zdrowotnej, głównie w przypadku leczenia obejmującego pobyt pacjenta w szpitalu na noc lub gdy leczenie wymaga użycia wysoce specjalistycznej infrastruktury lub aparatury. Takie rozwiązanie stosowane jest w ok. 1% przypadków.
04W dyrektywie potwierdzono, że pacjentowi chcącemu skorzystać z opieki zdrowotnej za granicą państwo pochodzenia powinno zwrócić koszty tych świadczeń opieki zdrowotnej, pod warunkiem że pacjent ma prawo do takiej opieki zdrowotnej w miejscu pochodzenia. Poziom zwrotu za leczenie za granicą jest równy poziomowi kosztów, które zostałyby poniesione przez państwo pochodzenia. Wymóg, by to pacjenci w pierwszej kolejności ponosili koszty, powszechnie uznaje się za istotne wyzwanie dla pacjentów4, choć stanowi on nieodłączną część koncepcji dyrektywy. W dyrektywie przewidziano jednak możliwość, by państwa członkowskie przedstawiały pacjentom szacunkowy koszt świadczeń opieki zdrowotnej. 05
Liczba obywateli, którzy na mocy dyrektywy ubiegają o zwrot kosztów za świadczenia opieki zdrowotnej uzyskane za granicą, jest niewielka (ok. 200 000 wniosków o zwrot kosztów rocznie – mniej niż 0,05% ogółu obywateli UE), jeśli porównać ją z liczbą osób korzystających z przepisów rozporządzenia w sprawie koordynacji systemów zabezpieczenia społecznego (ok. 2 mln wniosków rocznie dotyczących nieplanowanego leczenia zagranicą). Wydatki na transgraniczną opiekę zdrowotną poniesione w związku z przepisami dyrektywy szacuje się na 0,004% ogólnounijnego rocznego budżetu opieki zdrowotnej5. W badaniu Eurobarometr z 2015 r. stwierdzono, że mniej niż 20% obywateli było świadomych praw przysługujących im w odniesieniu do transgranicznej opieki zdrowotnej. Komisja nie ma aktualnych informacji dotyczących wiedzy obywateli na temat przepisów dyrektywy.
06Dyrektywę wykorzystuje się w różnym stopniu w poszczególnych państwach członkowskich. W odniesieniu do transgranicznych świadczeń opieki zdrowotnej niewymagających wcześniejszej zgody Francja zgłosiła największą liczbę pacjentów, którzy leczyli się za granicą (niemal 150 000 w 2016 r.), natomiast największą liczbę przyjętych pacjentów zagranicznych odnotowano w Hiszpanii, Portugalii i Belgii6. W tabeli 1 przedstawiono dane na temat mobilności pacjentów w ramach dyrektywy w 2016 r. we wszystkich państwach UE i EOG, z uwzględnieniem zarówno usług, jak i wyrobów medycznych w ramach transgranicznej opieki zdrowotnej. Dane liczbowe uwzględniają mobilność pacjentów w odniesieniu do terapii niewymagających uprzedniej zgody (łącznie 209 534 pacjentów) oraz leczenia wymagającego takiej zgody (łącznie 3 562 pacjentów).
Tabela 1 – Mobilność pacjentów w ramach dyrektywy w 2016 r.
| Pacjenci leczący się za granicą w 2016 r. | |
|---|---|
| Państwo | Liczba pacjentów |
| FRANCJA | 146 054 |
| DANIA | 25 343 |
| FINLANDIA | 11 427 |
| NORWEGIA | 10 301 |
| POLSKA | 8 647 |
| SŁOWACJA | 6 110 |
| SŁOWENIA | 1 835 |
| ZJEDNOCZONE KRÓLESTWO | 1 113 |
| IRLANDIA | 791 |
| CZECHY | 401 |
| LUKSEMBURG | 277 |
| WŁOCHY | 201 |
| CHORWACJA | 200 |
| RUMUNIA | 130 |
| ESTONIA | 80 |
| ISLANDIA | 53 |
| BELGIA | 30 |
| ŁOTWA | 27 |
| LITWA | 19 |
| CYPR | 13 |
| HISZPANIA | 11 |
| GRECJA | 10 |
| AUSTRIA | 9 |
| BUŁGARIA | 5 |
| PORTUGALIA | 5 |
| MALTA | 4 |
| NIEMCY | brak danych |
| WĘGRY | brak danych |
| NIDERLANDY | brak danych |
| SZWECJA | brak danych |
| Łącznie | 213 096 |
| Przyjęci zagraniczni pacjenci w 2016 r. | |
|---|---|
| Państwo | Liczba pacjentów |
| HISZPANIA | 46 138 |
| PORTUGALIA | 32 895 |
| BELGIA | 27 457 |
| NIEMCY | 27 034 |
| LUKSEMBURG | 12 530 |
| CZECHY | 12 300 |
| ESTONIA | 10 044 |
| WŁOCHY | 9 335 |
| POLSKA | 6 545 |
| SZWECJA | 6 162 |
| GRECJA | 5 639 |
| WĘGRY | 4 169 |
| AUSTRIA | 2 437 |
| CHORWACJA | 1 680 |
| NIDERLANDY | 1 653 |
| ZJEDNOCZONE KRÓLESTWO | 1 646 |
| RUMUNIA | 1 003 |
| BUŁGARIA | 686 |
| IRLANDIA | 674 |
| MALTA | 463 |
| FINLANDIA | 403 |
| FRANCJA | 371 |
| LITWA | 369 |
| NORWEGIA | 327 |
| SŁOWACJA | 259 |
| CYPR | 254 |
| DANIA | 198 |
| ŁOTWA | 167 |
| ISLANDIA | 141 |
| SŁOWENIA | 117 |
| Łącznie | 213 096 |
Źródło: Europejski Trybunał Obrachunkowy na podstawie sprawozdania zawierającego dane państw członkowskich za 2016 r. na temat świadczenia usług opieki transgranicznej zgodnie z dyrektywą 2011/24/UE, dostępnego na stronie internetowej Komisji.
07Komisja wspiera transgraniczną współpracę w zakresie opieki zdrowotnej za pośrednictwem licznych badań i inicjatyw, w tym inicjatywy Interreg7 finansowanej w ramach europejskich funduszy strukturalnych i inwestycyjnych. Państwa członkowskie są odpowiedzialne za zarządzanie własnymi systemami opieki zdrowotnej oraz za wszelkie mechanizmy wzajemnej współpracy. Takie mechanizmy są w wielu przypadkach opracowywane bez udziału Komisji. W niedawno opublikowanym badaniu Komisji na temat unijnych działań i inwestycji w zakresie współpracy transgranicznej w opiece zdrowotnej wskazano 423 projekty finansowane ze środków UE8 wspierające inicjatywy w tej dziedzinie w latach 2007–2017.
Transgraniczna wymiana danych dotyczących zdrowia
08Dyrektywa nakłada na Komisję obowiązek wspierania współpracy państw członkowskich w zakresie e-zdrowia i przewiduje utworzenie dobrowolnej sieci organów państw członkowskich (sieci e-zdrowie) z myślą o wspieraniu opracowywania wspólnych standardów przekazywania danych w ramach transgranicznej opieki zdrowotnej. Koncepcja e-zdrowia stanowi ponadto kluczowy element strategii Komisji dotyczącej jednolitego rynku cyfrowego, a rozwój e-zdrowia przebiega w UE w oparciu o działania wskazane w planach działania Komisji na rzecz e-zdrowia oraz strategii na rzecz e-zdrowia z 2018 r.9 Komisja ustanowiła ponadto w 2017 r. grupę roboczą, która analizuje zachęty i bariery, jeśli chodzi o zapewnienie bezpiecznej wymiany danych dotyczących zdrowia w całej UE.
09Komisja wspólnie z państwami członkowskimi buduje, na zasadzie dobrowolności, ogólnounijną infrastrukturę usług cyfrowych w dziedzinie e-zdrowia (eHDSI), która ma umożliwić transgraniczną wymianę danych na temat zdrowia pacjentów, w szczególności e-recept i kartotek pacjentów. W projekcie uczestniczą 22 państwa członkowskie10. Ma on doprowadzić do podłączenia krajowych systemów w dziedzinie e-zdrowia do unijnej infrastruktury za pośrednictwem specjalnego „portalu” znanego pod nazwą krajowego punktu kontaktowego w dziedzinie e-zdrowia (na rys. 1 przedstawiono procedurę transgranicznej wymiany e-recept).
Rys. 1
Transgraniczna wymiana e-recept

Źródło: Europejski Trybunał Obrachunkowy.
W niektórych państwach członkowskich11 korzystanie z e-recept jest powszechne, w innych natomiast usługi e-recept zaczęto wprowadzać w ramach projektów pilotażowych lub wdrażać dopiero niedawno. Ograniczona dostępność usług e-zdrowia na szczeblu krajowym stanowi jedno z zasadniczych wyzwań związanych z utworzeniem ogólnounijnej infrastruktury w dziedzinie e-zdrowia. Ponadto niektóre państwa członkowskie nie uczestniczą w ogóle we wspomnianej ogólnounijnej infrastrukturze (np. Dania; więcej informacji na temat aplikacji w dziedzinie e-zdrowia udostępnianych pacjentom w Danii można znaleźć w ramce 1) lub angażują się jedynie w niektóre z usług świadczonych w ramach tej infrastruktury.
Ramka 1
Aplikacje w dziedzinie e-zdrowia udostępniane pacjentom w Danii
Krajowy portal w dziedzinie e-zdrowia Sundhed.dk (https://www.sundhed.dk) pozwala duńskim pacjentom uzyskać dostęp do własnego profilu leczenia, sprawdzić zaplanowane wizyty u świadczeniodawców oraz samodzielnie zamówić określone leki, które już stosują. W 2018 r. duńskie organy pracowały nad projektem pilotażowym, w ramach którego do portalu miały zostać dodane nowe funkcjonalności, tak aby ułatwić planowanie wizyt pacjentom często odwiedzającym lekarzy (np. pacjentom cierpiącym na choroby przewlekłe).
Ponadto aplikacja mobilna Medicinkortet pozwala pacjentom wnioskować o przedłużenie posiadanych przez nich ważnych recept elektronicznych. Wszystkie recepty lekarskie wydawane w Danii są cyfrowe.
UE finansuje infrastrukturę w dziedzinie e-zdrowia za pośrednictwem instrumentu „Łącząc Europę”, w oparciu o doświadczenia z projektu pilotażowego w zakresie transgranicznej wymiany danych dotyczących zdrowia12. Państwa członkowskie, które chciałyby uruchomić transgraniczną wymianę danych dotyczących zdrowia, muszą przejść procedurę testowania i kontroli. Na zakończenie tej procedury grupa wyznaczonych przez państwa członkowskie ekspertów w dziedzinie e-zdrowia wydaje zalecenie. Następnie sieć e-zdrowie podejmuje ostateczną decyzję co do tego, które państwa mogą faktyczne uruchomić transgraniczną wymianę danych dotyczących zdrowia.
Transgraniczne inicjatywy na rzecz pacjentów cierpiących na rzadkie choroby
12W dyrektywie zdefiniowano rzadką chorobę jako dowolną chorobę, na którą zapada mniej niż pięć na 10 000 osób. Szacuje się, że od 6 000 do 8 000 rzadkich chorób dotyka od 6% do 8% populacji UE, tj. 27–36 mln ludzi. Specyfika rzadkich chorób – niewielka liczba pacjentów oraz niedobór odpowiedniej wiedzy, w tym wiedzy specjalistycznej – sprawiła, że Rada Unii Europejskiej określiła współpracę w tym obszarze jako „wyjątkową dziedzinę” i zwróciła uwagę, że „działania podejmowane w jej ramach mają bardzo wysoką wartość dodaną na poziomie wspólnotowym”13.
13W komunikacie z 2008 r. pt. „Rzadkie choroby: wyzwania stojące przed Europą” Komisja ustanowiła szczegółowe ramy polityki mające wspierać walkę z rzadkimi chorobami, w szczególności przez ustanowienie europejskich sieci referencyjnych. W dyrektywie nałożono na Komisję obowiązek wspierania państw członkowskich w rozwijaniu wspomnianych sieci. Na rys. 2 przedstawiono kolejne inicjatywy polityczne, które doprowadziły do powstania sieci.
Rys. 2
Kolejne inicjatywy polityczne prowadzące do utworzenia europejskich sieci referencyjnych
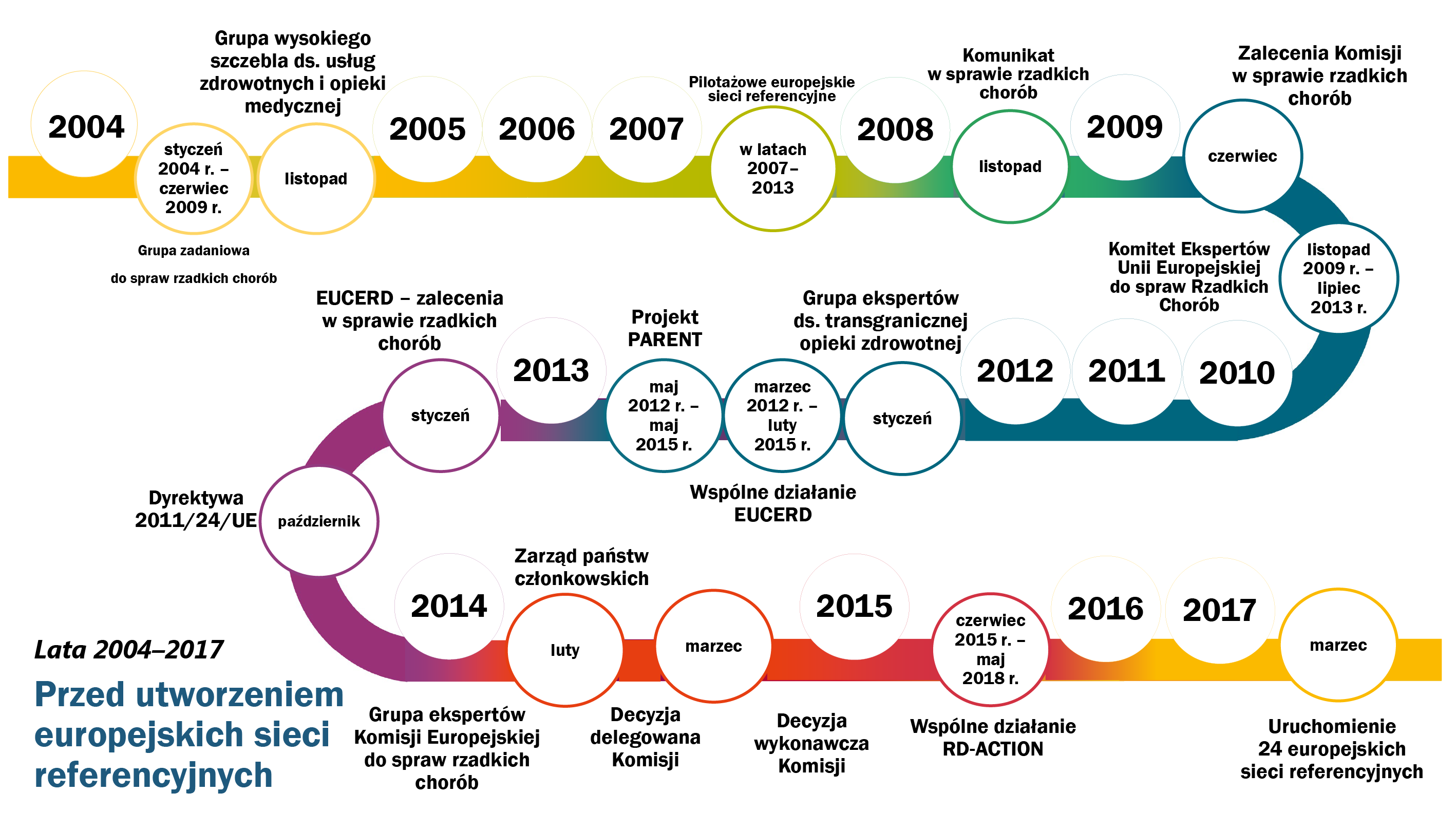
Źródło: Europejski Trybunał Obrachunkowy.
Europejskie sieci referencyjne mają doprowadzić do skrócenia czasu koniecznego do rozpoznania choroby i poprawić dostęp do odpowiedniego leczenia pacjentów cierpiących na rzadkie schorzenia. Sieci te mają w zamierzeniu stanowić platformę, w ramach której opracowuje się wytyczne, zapewnia szkolenia i prowadzi wymianę wiedzy. W 2017 r. uruchomiono 24 sieci odnoszące się do różnych kategorii rzadkich chorób. Każdej z nich przydzielono 1 mln euro środków z programu Unii w dziedzinie zdrowia na okres pięciu lat. Komisja finansuje również – w szczególności za pośrednictwem instrumentu „Łącząc Europę” – prowadzenie rejestrów pacjentów i działania wspierające sieci, a także opracowywanie narzędzi informatycznych.
15Jeśli przypadek danego pacjenta zostaje przekazany do europejskiej sieci referencyjnej, wówczas zwołuje się „wirtualny” panel ekspertów medycznych, wykorzystując do tego celu kliniczny system zarządzania przypadkami chorobowymi (Clinical Patient Management System – CPMS), internetową aplikację udostępnioną przez Komisję w listopadzie 2017 r. Aplikacja pozwala lekarzom wymieniać informacje, dane i badania obrazowe pojedynczych pacjentów – po uzyskaniu od nich stosownej zgody – oraz uzyskać wsparcie w diagnostyce i leczeniu. 73% członków europejskich sieci referencyjnych zarejestrowało się, by móc korzystać z aplikacji, i do grudnia 2018 r. zwołano 333 panele (w ramce 2 przedstawiono przypadki pacjentów cierpiących na rzadkie choroby objętych konsultacjami w ramach europejskich sieci referencyjnych).
Ramka 2
Przypadki pacjentów cierpiących na rzadkie choroby objętych konsultacjami w ramach europejskiej sieci referencyjnej.
W 2018 r. w ramach europejskiej sieci referencyjnej do spraw nowotworów u dzieci i młodzieży przedstawiono przypadki dwojga dzieci z Litwy dotkniętych rzadkimi nowotworami dziecięcymi. Na podstawie zaleceń specjalistów przekazanych w ramach sieci dzieci te poddano nowym rodzajom leczenia.
W 2017 r. w ramach europejskiej sieci referencyjnej do spraw rzadkich i złożonych przypadków epilepsji przedstawiono przypadek czteroletniego chłopca z Finlandii, który cierpiał na szczególną anomalię mózgu skutkującą ciężką epilepsją. Prowadzący chłopca lekarz z Finlandii skonsultował się za pośrednictwem sieci ze specjalistami, aby uzyskać zalecenia co do odpowiedniego leczenia. W dyskusję i wymianę wiedzy dotyczące leczenia chłopca zaangażowali się specjaliści z co najmniej sześciu innych państw.
W obu przypadkach sieci pozwoliły na przekazanie cennych zaleceń na temat metod leczenia pacjentów.
Zarząd państw członkowskich do spraw europejskich sieci referencyjnych14 zatwierdza utworzenie sieci i członkostwo w nich. Z końcem 2018 r. w europejskich sieciach referencyjnych uczestniczyło 952 świadczeniodawców opieki zdrowotnej (tj. instytutów, jednostek szpitalnych) z ponad 300 szpitali zlokalizowanych w całej UE. Żadna sieć nie obejmowała więcej niż 19 państw członkowskich. Na rys. 3 pokazano, że na terenie UE rozmieszczenie świadczeniodawców opieki zdrowotnej uczestniczących w europejskich sieciach referencyjnych jest zróżnicowane. Największa liczba tych świadczeniodawców pochodzi z Włoch. W tym państwie członkowskim od dawna realizuje się krajową strategię działań dotyczących rzadkich chorób oraz krajową sieć specjalistycznych szpitali i ośrodków, które mają kwalifikacje, by zapewnić wsparcie pacjentom cierpiącym na rzadkie choroby.
Rys. 3
Rozmieszczenie świadczeniodawców opieki zdrowotnej uczestniczących w europejskich sieciach referencyjnych na terenie UE

Źródło: Europejski Trybunał Obrachunkowy na podstawie danych dotyczących świadczeniodawców opieki zdrowotnej uczestniczących w europejskich sieciach referencyjnych w podziale na poszczególne państwa członkowskie. Dane zostały przesłane przez Komisję w lutym 2019 r.
Zakres kontroli i podejście kontrolne
17Jednym z celów strategicznych Europejskiego Trybunału Obrachunkowego jest analiza wykonania zadań w obszarach, w których działania UE mają znaczenie dla obywateli15. Udoskonalenie europejskiej infrastruktury i usług w dziedzinie zdrowia, a także poprawa ich dostępności i skuteczności są obszarem, w którym działania Unii mogą przynieść obywatelom UE wartość dodaną. Trybunał rozpoczął niniejszą kontrolę dziesięć lat po przyjęciu przez Komisję strategii dotyczącej rzadkich chorób i uruchomieniu dużego unijnego projektu pilotażowego w zakresie transgranicznej wymiany danych dotyczących zdrowia. Kontrola przeprowadzona przez Trybunał miała na celu udzielenie odpowiedzi na następujące pytanie:
Czy działania UE w zakresie transgranicznej opieki zdrowotnej przynoszą korzyści pacjentom?
18Trybunał zbadał w szczególności, czy:
- Komisja sprawowała nadzór nad wdrożeniem unijnej dyrektywy w sprawie transgranicznej opieki zdrowotnej w odpowiedni sposób;
- rezultaty osiągnięte do tej pory w odniesieniu do transgranicznej wymiany danych dotyczących zdrowia spełniają oczekiwania;
- działania UE w dziedzinie rzadkich chorób wnoszą wartość dodaną w wysiłki państw członkowskich na rzecz ułatwienia pacjentom dostępu do transgranicznej opieki zdrowotnej.
Kontrola Trybunału objęła okres rozpoczynający się w 2008 r., gdy Komisja przyjęła strategię dotyczącą rzadkich chorób oraz uruchomiono duży unijny projekt pilotażowy w zakresie transgranicznej wymiany danych dotyczących zdrowia. Prace kontrolne zrealizowano w okresie od lutego do listopada 2018 r. Przeprowadzono wywiady z przedstawicielami Komisji z Dyrekcji Generalnej ds. Zdrowia i Bezpieczeństwa Żywności, Dyrekcji Generalnej ds. Sieci Komunikacyjnych, Treści i Technologii, Wspólnego Centrum Badawczego, a także z przedstawicielami organów odpowiedzialnych za wdrożenie dyrektywy w pięciu państwach członkowskich16. Przy wyborze państw członkowskich uwzględniono najistotniejsze projekty finansowane ze środków UE, które dotyczyły transgranicznej wymiany danych w zakresie zdrowia.
20Trybunał przeprowadził również ankietę wśród wszystkich przedstawicieli państw członkowskich zasiadających w grupie ekspertów ds. transgranicznej opieki zdrowotnej, aby zapoznać się z ich opiniami na temat najistotniejszych zmian, które zaszły w ostatnim czasie, oraz wyzwań utrudniających pacjentom dostęp do transgranicznej opieki zdrowotnej. Ankieta objęła również przedstawicieli sieci e-zdrowie w odniesieniu do ich opinii na temat prac Komisji dotyczących transgranicznej wymiany danych dotyczących pacjentów. Otrzymano 15 odpowiedzi z grupy ekspertów ds. transgranicznej opieki zdrowotnej oraz 10 z sieci e-zdrowie.
21Trybunał przeprowadził kontrolę projektów finansowanych ze środków UE mających na celu usprawnienie dostępu do transgranicznej opieki zdrowotnej, w tym projektu na rzecz transgranicznej wymiany danych dotyczących zdrowia oraz na rzecz opracowania i utrzymania europejskiej platformy rejestrów rzadkich chorób. Zorganizowano panel ekspertów, aby uzyskać niezależne opinie na temat unijnej polityki w dziedzinie rzadkich chorób oraz europejskich sieci referencyjnych.
Uwagi
Komisja zadbała o wdrożenie unijnej dyrektywy w sprawie transgranicznej opieki zdrowotnej
22Aby zapewnić nadzór nad wdrożeniem dyrektywy, Komisja musi monitorować i egzekwować transpozycję jej przepisów przez państwa członkowskie za pośrednictwem kontroli kompletności i zgodności. Ponadto Komisja jest zobowiązana do przekazywania informacji na temat funkcjonowania dyrektywy oraz do zapewnienia odpowiednich wytycznych krajowym punktom kontaktowym odpowiedzialnym za informowanie pacjentów na temat transgranicznej opieki zdrowotnej.
Komisja monitorowała i egzekwowała wdrożenie przepisów dyrektywy
23Po upływie terminu transpozycji dyrektywy z dniem 25 października 2013 r. oraz po skontrolowaniu kompletności transpozycji dokonanej przez państwa członkowskie Komisja wszczęła 26 postępowań w sprawie uchybienia zobowiązaniom państwa członkowskiego w związku z opóźnionym lub niepełnym powiadomieniem o środkach transpozycji. Ponadto Komisja wszczęła 21 takich postępowań w związku z opóźnionym lub niepełnym powiadomieniem o transpozycji dyrektywy wykonawczej w sprawie uznawania recept lekarskich wystawionych w innym państwie członkowskim17. Po tym, jak wszystkie państwa członkowskie przekazały kompletne powiadomienia o środkach transpozycji, Komisja zamknęła wszystkie te postępowania do listopada 2017 r.
24Komisja sprawdza prawodawstwo państw członkowskich w celu ustalenia, czy państwa te dokonały prawidłowej transpozycji przepisów dyrektywy. Aby odpowiednio ukierunkować te kontrole, Komisja rozpoznała cztery obszary priorytetowe, w których występują przeszkody dla pacjentów transgranicznych: systemy zwrotu kosztów, wymaganie uprzedniej zgody, wymogi administracyjne oraz obciążanie kosztami przyjmowanych pacjentów zagranicznych. Po przeprowadzeniu powiązanych kontroli Komisja wszczęła z własnej inicjatywy 11 postępowań w sprawie uchybienia zobowiązaniom państwa członkowskiego, z których cztery zostały zamknięte do listopada 2018 r. po wprowadzeniu przez państwa członkowskie zmian do stosownych środków transpozycji.
25Trybunał uznaje, że kontrole przeprowadzone przez Komisję doprowadziły do usprawnienia systemów i praktyk stosowanych w państwach członkowskich.
Komisja przedstawiała informacje na temat funkcjonowania dyrektywy w sposób terminowy
26Na Komisji spoczywa obowiązek sporządzania raz na trzy lata, począwszy od 2015 r., sprawozdania w sprawie funkcjonowania dyrektywy18. Sprawozdania te powinny obejmować informacje na temat przepływów pacjentów i kosztów związanych z ich mobilnością. Wprawdzie dyrektywa nie zobowiązuje państw członkowskich do gromadzenia danych na temat przepływów pacjentów, wskazuje jednak, że muszą one zapewnić Komisji wsparcie i wszystkie dostępne informacje na potrzeby sporządzania wspomnianego sprawozdania. W 2013 r. państwa członkowskie zgodziły się corocznie udostępniać Komisji szczegółowe dane.
27Większość państw członkowskich z opóźnieniem przyjęła krajowe środki transpozycji (zob. pkt 23), co skutkowało opóźnionym przekazaniem danych Komisji w 2015 r. W 2017 r. informacje te przekazało 26 państw członkowskich, ale w przypadku sześciu z nich dane nie były kompletne. Ponadto nie można było dokonać porównań tych danych między krajami, ponieważ niektóre państwa członkowskie przekazały informacje na temat wszystkich zwrotów kosztów, nie wskazując przy tym, czy zwrotu tego dokonano na podstawie dyrektywy, czy rozporządzenia w sprawie koordynacji systemów zabezpieczenia społecznego. Komisja przyznaje, że dane zawarte w sprawozdaniach nie są wystarczająco dokładne – przykładowo, przegląd przepływów pacjentów był niekompletny. W tabeli 1 wskazano, że cztery państwa członkowskie nie przekazały informacji na temat pacjentów udających się na leczenie za granicę w 2016 r.
28Pomimo tych trudności Komisji udało się wypełnić obowiązek sprawozdawczy w terminie. Ostatnie sprawozdanie Komisja przyjęła we wrześniu 2018 r. Przedstawiono w nim przegląd przepływów pacjentów oraz wpływu finansowego transgranicznej opieki zdrowotnej świadczonej w ramach dyrektywy.
Komisja zapewniła krajowym punktom kontaktowym wytyczne dotyczącego lepszego informowania na temat transgranicznej opieki zdrowotnej
29Komisja zapewnia krajowym punktom kontaktowym wsparcie i wytyczne, tak aby udostępnić pacjentom jasne i kompleksowe informacje na temat praw przysługujących im w zakresie transgranicznej opieki zdrowotnej. W tym celu Komisja opublikowała szereg stosownych badań19. Przed upływem terminu transpozycji dyrektywy w 2013 r. Komisja przesłała państwom członkowskim notę z wytycznymi w sprawie dwóch ścieżek podjęcia leczenia w ramach transgranicznej opieki zdrowotnej dostępnych pacjentom: dyrektywy w sprawie transgranicznej opieki zdrowotnej oraz rozporządzenia w sprawie koordynacji systemów zabezpieczenia społecznego.
30Tymczasem na mniej niż połowie stron internetowych krajowych punktów kontaktowych przedstawiono te dwa różne sposoby, jakie pozwalają pacjentom uzyskać dostęp do opieki zdrowotnej w innych państwach20. W marcu 2018 r. Komisja podjęła starania, by zaradzić ewentualnym pomyłkom między dwoma wspomnianymi aktami prawnymi, i zorganizowała warsztaty budowania zdolności dla krajowych punktów kontaktowych oraz opracowała zestaw praktycznych narzędzi dla tych punktów, tak aby ułatwić przekazywanie informacji pacjentom. Przeprowadzone przez Trybunał badanie ankietowe wykazało, że właściwe organy państw członkowskich przyjęły te zestawy narzędzi z zadowoleniem, ale do wyjaśnienia różnic między dwoma aktami prawnymi konieczne są dalsze prace.
31W niedawnym badaniu Komisji21 stwierdzono, że wprawdzie informacje udostępniane pacjentom na stronach internetowych krajowych punktów kontaktowych były, ogólnie rzecz ujmując, odpowiednie i spełniały wymogi dyrektywy, niemniej na stronach tych można by przedstawić więcej informacji na temat praw pacjentów zagranicznych korzystających z leczenia oraz zwrotu kosztów transgranicznej opieki zdrowotnej w przypadku pacjentów leczących się za granicą. Ponadto w sprawozdaniu w sprawie dyrektywy sporządzonym przez Parlament Europejski zwrócono uwagę, że „zasadniczo na stronach krajowych punktów kontaktowych brakuje szczegółowych informacji o prawach pacjentów”22.
32Krajowe punkty kontaktowe nie są zobowiązane na mocy dyrektywy do uwzględniania na swoich stronach internetowych informacji na temat europejskich sieci referencyjnych. Trybunał ustalił, że niektóre z krajowych punktów zamieściły takie informacje, inne natomiast rozważały, w jaki sposób je zaprezentować. Przedstawiciele Niemiec, Irlandii, Estonii i Zjednoczonego Królestwa wyrazili już zainteresowanie nawiązaniem kontaktów w tej sprawie z zarządem państw członkowskich do spraw europejskich sieci referencyjnych23. Eksperci do spraw rzadkich chorób, do których zwrócił się Trybunał, uważali, że krajowe punkty kontaktowe powinny udostępniać takie informacje na temat sieci.
Transgraniczna wymiana danych dotyczących zdrowia pacjentów – rezultaty osiągnięte w momencie kontroli nie spełniły pokładanych w niej dużych oczekiwań
33Ustanowienie mechanizmów wymiany danych dotyczących zdrowia pacjentów w obrębie UE wymaga opracowania jasnych ram strategicznych i ram zarządzania, które będą wspierane przez państwa członkowskie. Należy wprowadzić przejrzyste cele, a wyniki powinny być regularnie monitorowane. Przed przystąpieniem do realizacji projektów na dużą skalę Komisją powinna oszacować, przy wsparciu państw członkowskich, liczbę potencjalnych użytkowników. Należy przy tym wyciągnąć wnioski z wcześniejszych projektów pilotażowych.
Strategia z 2018 r. w dziedzinie e-zdrowia nie zawiera planu wdrożenia
34W planie działań Komisji w dziedzinie e-zdrowia określono podejście do kwestii e-zdrowia, w tym do transgranicznej wymiany danych dotyczących zdrowia pacjentów. Bieżący plan działania obejmuje lata 2012–2020. W kwietniu 2018 r. Komisja przyjęła natomiast nową strategię w dziedzinie e-zdrowia24, obejmującą szerszy zakres tematów niż ten plan działania. W szczególności uwzględnia ona możliwość rozszerzenia transgranicznej wymiany danych na wymianę elektronicznych kartotek.
35W 2014 r. Komisja opublikowała śródokresową ocenę planu działania w dziedzinie e-zdrowia25. Wprawdzie wyniki oceny były ogólnie pozytywne, odnotowano jednak pewne uchybienia i zalecono, by Komisja przystąpiła do aktualizacji planu, tak aby uwzględnić najistotniejsze kwestie, zapewnić przejrzystą strukturę zarządzania i stworzyć mechanizm monitorowania i koordynacji.
36Komisja wdrożyła większość działań przewidzianych w planie działania w dziedzinie e-zdrowia, nie zastosowała się jednak do zalecenia z oceny z 2014 r, by przeprowadzić aktualizację planu, ani nie wprowadziła do niego zmian w celu uwzględnienia strategii z 2018 r. w dziedzinie e-zdrowia. W związku z tym w planie nie wzięto pod uwagę istotnych kwestii, takich jak wejście w życie ogólnego rozporządzenia o ochronie danych. Co więcej, Komisja nie określiła obowiązków związanych z wdrożeniem planu.
37Strategia z 2018 r. w dziedzinie e-zdrowia odnosi się do bieżących wyzwań takich jak wejście w życie ogólnego rozporządzenia o ochronie danych i cyberzagrożenia. Niemniej strategia ta nie zawiera planu wdrożenia, w którym wskazano by terminy osiągnięcia oczekiwanych rezultatów i produktów, co pozwoliłoby się zapoznać się z podejściem Komisji do wdrożenia strategii w zakresie e-zdrowia. W momencie uruchomienia przez Komisję strategii jedyna ocena planu działania na lata 2012–2020 pochodziła z 2014 r.
Komisja nie doceniła trudności związanych z wdrożeniem ogólnounijnej infrastruktury usług cyfrowych w dziedzinie e-zdrowia
38Komisja prowadziła prace na temat wymiany danych dotyczących zdrowia pacjentów między państwami członkowskimi w dwóch etapach: w ramach projektu pilotażowego (epSOS)26 realizowanego od 2008 r. do 2012 r. o wartości 18 mln euro oraz trwającego projektu wdrożeniowego (dotyczącego ogólnounijnej infrastruktury usług cyfrowych w dziedzinie e-zdrowia) o budżecie 35 mln euro27 uruchomionego w 2015 r.
39Celem projektu epSOS było opracowanie ram w zakresie technologii i infrastruktury ICT pozwalających na bezpieczne transgraniczne udostępnianie danych dotyczących zdrowia pacjenta. Projekt pilotażowy miał pozwolić na zbadanie wykonalności pod kątem funkcjonalnym, technicznym i prawnym oraz zatwierdzenie proponowanego rozwiązania na potrzeby transgranicznej wymiany danych dotyczących zdrowia. Miał on „zademonstrować praktyczne wdrożenie rozwiązania w zróżnicowanych warunkach w szeregu uczestniczących państw”.
40W ramach projektu opracowano definicje danych zawartych w kartotekach i e‑receptach (zob. pkt 09), a także mechanizmy testowania, dokonywania przeglądu i zatwierdzania transgranicznej wymiany danych dotyczących zdrowia. Przyczynił się on do opracowania specyfikacji i wytycznych dotyczących interoperacyjności w dziedzinie e-zdrowia. W ramach projektu wprowadzono wspólne standardy promujące taką wymianę. Przy okazji państwa członkowskie wyraziły wolę dalszej współpracy w tym obszarze.
41Na etapie planowania projektu nie określono zakresu i skali testów, jakie należało koniecznie przeprowadzić przed podjęciem praktycznego wdrożenia. Testowanie wykonalności proponowanego rozwiązania obejmowało 43 transfery danych dotyczących pacjentów. Oznacza to, że w projekcie jedynie w ograniczonym zakresie wykazano praktyczne funkcjonowanie proponowanego rozwiązania. W końcowej ocenie projektu zewnętrzni oceniający stwierdzili we wnioskach, że liczba rzeczywistych kartotek pacjentów i e-recept była „zbył mała, by można było uznać, iż usługi epSOS są operacyjne i wiarygodne”28. Tymczasem tę wymianę danych – choć miała ona ograniczony zakres – Komisja uznała za wystarczające potwierdzenie wykonalności koncepcji ogólnounijnej infrastruktury usług cyfrowych w dziedzinie e-zdrowia.
42Komisja dokonała oceny projektu epSOS w 2014 r. W ocenie odnotowano, że „choć oczekiwania co do statystycznie istotnej liczby wymian danych dotyczących pacjentów nie zostały jak dotychczas spełnione w ramach projektu epSOS, to podejście do transgranicznej interoperacyjności zaproponowane w projekcie okazało się zasadne”29. Tymczasem problemy w zakresie interoperacyjności na poziomie prawnym, organizacyjnym i semantycznym okazały się większe niż się podziewano. Komisja wykryła również, że wykonawcy projektu ubiegali się o zwrot kosztów niekwalifikowalnych, głównie w odniesieniu do kosztów zatrudnienia pracowników. W momencie prowadzenia prac kontrolnych Komisja wciąż odzyskiwała zwrócone niekwalifikowalne wydatki, sięgające 42% wypłaconych środków.
43Pomimo tych wyzwań w 2015 r. Komisja zdecydowała się wykorzystać produkty projektu pilotażowego jako podstawę do rozwinięcia ogólnounijnej infrastruktury usług cyfrowych w dziedzinie e-zdrowia (eHDSI) na dużą skalę. Architektura eHDSI, podobnie jak specyfikacje techniczne i semantyczne oraz rozwiązania prawne, organizacyjne i polityczne wiążące uczestniczące państwa członkowskie powstały w oparciu o produkty uzyskane w projekcie epSOS.
44Trybunał wykrył uchybienia w sposobie, w jaki Komisja przygotowała się do tego złożonego przedsięwzięcia, w szczególności niewystarczające oszacowanie liczby potencjalnych użytkowników (pacjentów i świadczeniodawców, tj. aptek i szpitali) transgranicznych usług w dziedzinie e-zdrowia świadczonych za pośrednictwem eHDSI oraz niewystarczającą ocenę efektywności tych usług pod względem kosztów przed uruchomieniem eHDSI. W związku z tym Trybunał stwierdza, że Komisja nie doceniła trudności związanych z wdrożeniem ogólnounijnej infrastruktury usług cyfrowych w dziedzinie e-zdrowia.
Komisja przeszacowała prawdopodobne wykorzystanie infrastruktury usług cyfrowych w dziedzinie e-zdrowia
45Zaprezentowane przez Komisję informacje na temat prawdopodobnego zakresu transgranicznej wymiany informacji dotyczących zdrowia były nadmiernie optymistyczne (zob. ramka 3).
Ramka 3
Zaprezentowane przez Komisję informacje na temat wykorzystania ogólnounijnej infrastruktury usług cyfrowych w dziedzinie e-zdrowia
W grudniu 2017 r. Komisja ogłosiła, że „w 2018 r. dwanaście państw członkowskich UE rozpocznie regularną wymianę danych dotyczących pacjentów”30.
Na stronie internetowej poświęconej zarządzaniu infrastrukturą w dziedzinie e-zdrowia Komisja stwierdziła, że „oczekuje się, iż w okolicach 2019 r. transgraniczna wymiana danych dotyczących zdrowia stanie się akceptowaną praktyką w ramach krajowych systemów opieki zdrowotnej w UE [...]”31.
Przy ocenie osiągniętych wyników Komisja poinformowała w 2017 r., że dziesięć państw członkowskich „miało zdolność do wymiany danych dotyczących zdrowia oraz dołączenia do transgranicznych usług informacyjnych w dziedzinie e-zdrowia”32. Tę liczbę określono w oparciu o sprawozdania własne państw członkowskich dotyczące stworzenia krajowych portali w dziedzinie e-zdrowia. Obejmowała ona państwa członkowskie, które dopiero zaczęły budować swoje portale, ale nie potwierdziły gotowości do transgranicznej wymiany danych dotyczących zdrowia.
W momencie zakończenia kontroli (listopad 2018 r.) transgraniczna wymiana danych dotyczących zdrowia pacjentów za pośrednictwem unijnej infrastruktury w dziedzinie e-zdrowia jeszcze się nie rozpoczęła (zob. załącznik II, w którym przedstawiono planowane daty uruchomienia transgranicznej wymiany danych dotyczących zdrowia w poszczególnych państwach członkowskich). Do tego czasu Komisja przeprowadziła ocenę zdolności siedmiu państw członkowskich33 do faktycznego uruchomienia transgranicznej wymiany. Cztery z tych państw (Czechy, Estonia, Luksemburg i Finlandia) poddano kontrolom następczym. W październiku 2018 r. grupa wyznaczonych przez państwa członkowskie ekspertów w dziedzinie e-zdrowia zaleciła, by uruchomiły one wymianę danych, pod warunkiem że wdrożono wszystkie działania naprawcze. Na rys. 4 przedstawiono proces pozwalający państwu członkowskiemu przystąpić do transgranicznych usług informacyjnych w dziedzinie e-zdrowia oraz sytuację w tym zakresie w 2018 r.
Rys. 4
Proces przystępowania do transgranicznych usług informacyjnych w dziedzinie e-zdrowia – stan na 2018 r.

Źródło: Europejski Trybunał Obrachunkowy na podstawie informacji przedstawionych przez Komisję.
Trybunał stwierdził ponadto, że cztery państwa członkowskie uczestniczące w ogólnounijnej infrastrukturze w dziedzinie e-zdrowia dopuszczono do świadczenia różnych usług e-zdrowia. W momencie prowadzenia kontroli Finlandia była gotowa do przesyłania e-recept, Estonia natomiast mogła je przyjmować (na początku 2019 r. była to jedyna dostępna możliwość wymiany e-recept w Europie). Jak wynika z danych Komisji, w okresie od stycznia do końca lutego 2019 r. zrealizowano w ten sposób 550 recept. Czechy i Luksemburg były w stanie przyjmować elektroniczne kartoteki z zagranicy, niemniej żadne państwo członkowskie nie mogło ich przesyłać za pośrednictwem eHDSI. Ponadto w początkowym okresie jedynie niektórzy krajowi świadczeniodawcy i apteki będą korzystać w tych państwach ze wspomnianego systemu. W ramce 4 wyjaśniono, w jaki sposób pacjenci mogą czerpać korzyści z transgranicznej wymiany e-recept i kartotek elektronicznych.
Ramka 4
Transgraniczna wymiana
E-recepty (przypadek Finlandii i Estonii)...
Jeśli pacjent posiadający e-receptę wystawioną w Finlandii uda się do estońskiej apteki po przepisany lek, apteka powinna zarejestrować identyfikator pacjenta. Następnie apteka przesyła dane z recepty, o ile pacjent udzielił stosownej zgody, do estońskiego portalu w dziedzinie e-zdrowia, skąd zostaną one przekazane do analogicznego fińskiego portalu. Gdy estońska apteka wyda już pacjentowi lek, fiński portal powinien otrzymać informację, że e-recepta została zrealizowana (zob. rys. 1).
...oraz elektroniczne kartoteki.
W razie nagłych przypadków lub nieplanowanej wizyty u świadczeniodawcy opieki zdrowotnej za granicą pracownicy medyczni mogą zyskać za pośrednictwem unijnego portalu w dziedzinie e-zdrowia elektroniczny dostęp do podstawowych informacji medycznych na temat pacjenta przechowywanych w państwie pochodzenia pacjenta. Kartoteka może zawierać informacje na temat alergii pacjenta na leki i ułatwić diagnozowanie pacjenta za granicą.
Europejskie sieci referencyjne do spraw rzadkich chorób stanowią ambitną innowację, ale nie dowiedziono jeszcze trwałości tej inicjatywy
48Aby Komisja mogła skutecznie wspierać państwa członkowskie w rozwijaniu europejskich sieci referencyjnych, wsparcia takiego należałoby udzielić w ramach obowiązujących przepisów i zgodnie ze spójną strategią i przejrzystym planem działania.
Komisja nie zaktualizowała ram działań UE w zakresie rzadkich chorób
49Rozwój europejskich sieci referencyjnych stanowi część ogólnounijnej polityki dotyczącej rzadkich chorób, obejmującej elementy takie jak wsparcie na rzecz opracowania krajowych planów dotyczących rzadkich chorób, udoskonalenie standardowej nomenklatury dotyczącej tych chorób oraz wsparcie badań naukowych nad tymi chorobami. Celem komunikatu Komisji z 2008 r. w sprawie rzadkich chorób było „zachęcani[e] do współpracy między państwami członkowskimi oraz, w razie konieczności, wspierani[e] ich działań”. Miał on doprowadzić do ustanowienia „ogólnej strategii Wspólnoty w zakresie udzielania wsparcia państwom członkowskim”34 w eliminowaniu chorób rzadkich. Rada poparła to podejście w zaleceniu z dnia 8 czerwca 2009 r. w sprawie działań w dziedzinie rzadkich chorób35.
50Komisja opublikowała w 2014 r. sprawozdanie z wdrożenia obydwu tych dokumentów, zarówno komunikatu, jak i zalecenia Rady. W sprawozdaniu stwierdzono, że „ogólnie rzecz ujmując, cele komunikatu i zalecenia Rady zostały osiągnięte”. Cele te obejmowały wprowadzenie przejrzystej definicji rzadkich chorób oraz udoskonalenie nomenklatury dotyczącej tych chorób w ramach systemów opieki zdrowotnej. W sprawozdaniu zaznaczono jednak, że „wciąż wiele pozostaje do zrobienia” w kwestii zapewnienia pacjentom cierpiącym na rzadkie choroby koniecznej opieki w UE, i zwrócono uwagę na brak strategii w tej dziedzinie w niektórych państwach członkowskich, co wymaga podjęcia dalszych działań. W dokumencie zawarto wykaz 11 działań planowanych przez Komisję, w tym dalszego wsparcia na rzecz europejskiej platformy rejestrów rzadkich chorób oraz na rzecz opracowywania planów w tej dziedzinie.
51Pomimo że cele uznano za osiągnięte, dziewięć spośród 11 planowanych działań stanowi kontynuację obowiązujących inicjatyw. Komisja nie zaktualizowała własnej strategii dotyczącej rzadkich chorób od 2008 r., choć zarządza istotnymi inicjatywami w tym zakresie, takimi jak sieci oraz ogólnounijna platforma rejestrów rzadkich chorób
Komisja nie wykorzystała wniosków z doświadczeń zdobytych w ramach projektów pilotażowych europejskich sieci referencyjnych
52W latach 2007–2013 Komisja przekazała środki na dziesięć pilotażowych sieci referencyjnych. Komitet Ekspertów Unii Europejskiej do spraw Rzadkich Chorób (EUCERD)36 przeprowadził ocenę tych pilotażowych sieci referencyjnych i w 2011 r. opublikował dokument pt. „Wstępna analiza wyników i doświadczeń uzyskanych w ramach pilotażowych europejskich sieci referencyjnych w zakresie rzadkich chorób”. Niemniej ustanawiając europejskie sieci referencyjne, Komisja podjęła jedynie część problemów poruszonych w ocenie z 2011 r., np. wsparcie na rzecz rejestrów pacjentów, potrzebę opracowania specjalistycznego narzędzia ICT oraz konieczność wprowadzenia u każdego członka sieci procesów kontroli jakości w odniesieniu do stosowanych praktyk leczenia. Wciąż nie rozwiązano poniższych kwestii:
- trwałość funkcjonowania sieci po zakończeniu pierwszego okresu finansowania;
- opracowanie systemu ciągłego monitorowania i kontroli jakości obejmującego członków sieci;
- przeszkody administracyjne i koszty finansowe związane z rozbudową sieci;
- trwałe wsparcie na rzecz rejestrów pacjentów.
Od momentu utworzenia w 2014 r. zarząd państw członkowskich do spraw sieci prowadził prace nad tymi nierozwiązanymi kwestiami. Poczyniono postępy w sprawie systemu ciągłego monitorowania i kontroli jakości (we wrześniu 2018 r. zarząd zatwierdził zestaw kluczowych wskaźników, które mają być gromadzone przez europejskie sieci referencyjne). Niemniej pojawiły się nowe wyzwania, które wciąż nie zostały podjęte, takie jak włączenie sieci do krajowych systemów opieki zdrowotnej oraz współpraca z podmiotami z sektora. Na rys. 5 przedstawiono różne wyzwania, którym muszą sprostać sieci. Komisja, zarząd państw członkowskich do spraw sieci oraz grupa koordynatorów sieci pracują obecnie nad tymi kwestiami.
Rys. 5
Wyzwania związane z rozwojem europejskich sieci referencyjnych

Źródło: Europejski Trybunał Obrachunkowy, w oparciu o protokoły zarządu państw członkowskich do spraw europejskich sieci referencyjnych.
Komisja zapewniła wsparcie na rzecz utworzenia 24 europejskich sieci referencyjnych, ale nie stworzyła skutecznego systemu oceny uczestników
54W dyrektywie nałożono na Komisję obowiązek ustanowienia szczegółowych kryteriów i warunków, które muszą spełnić świadczeniodawcy opieki zdrowotnej, aby móc przyłączyć się do europejskiej sieci referencyjnej37. Komisja skorzystała z usług doradców, by opracować zestaw wytycznych dla podmiotów wnioskujących o uczestnictwo w sieci, jak i dla niezależnego organu oceniającego, który miał rozpatrywać wnioski o utworzenie europejskich sieci referencyjnych oraz wnioski poszczególnych świadczeniodawców. Komisja podjęła starania na rzecz rozpowszechniania wiedzy o uruchomieniu europejskich sieci referencyjnych wśród istotnych zainteresowanych stron. Początkowy cel Komisji polegający na zapewnieniu wsparcia dla utworzenia dziesięciu takich sieci38 został przekroczony, ponieważ utworzono 24 europejskie sieci referencyjne (ich wykaz zamieszczono załączniku III).
55Na rys. 6 przedstawiono proces oceny wniosków poszczególnych świadczeniodawców o przyłączenie się do europejskiej sieci referencyjnej. Przed złożeniem wniosku każdy świadczeniodawca musi w pierwszej kolejności zyskać poparcie właściwego organu z danego państwa członkowskiego. Procedura oceny na szczeblu UE ograniczała się do weryfikacji kwalifikowalności wniosków i zbadania próby 20% pojedynczych wniosków.
Rys 6
Schemat postępowania w ramach kontroli jakości i proces oceny wniosków poszczególnych świadczeniodawców o przyłączenie się do europejskiej sieci referencyjnej

Źródło: analiza Europejskiego Trybunału Obrachunkowego w oparciu o dokumenty dostarczone przez Agencję Wykonawczą ds. Konsumentów, Zdrowia, Rolnictwa i Żywności.
Niezależny organ oceniający sporządził 62 negatywne sprawozdania wstępne. We wszystkich tych przypadkach wnioskodawcy przedstawili informacje39 dotyczące nierozwiązanych problemów, które umożliwiły organowi oceniającemu wydanie pozytywnej opinii. Niemniej przeprowadzone przez Trybunał badanie próby40 sprawozdań z oceny wykazało, że w wielu przypadkach organ oceniający wydał końcową pozytywną opinię na podstawie niekompletnych informacji. W rezultacie całego procesu oceny z ogólnej liczby 953 świadczeniodawców 952 zostało dopuszczonych do uczestnictwa w europejskich sieciach referencyjnych. Trybunał stwierdza, że w praktyce cały proces oceny wnosi jedynie niewielką wartość dodaną do procesu utworzenia europejskich sieci referencyjnych.
57System oceny w oparciu o badanie próby nie był pierwotnie uzupełniony żadnymi innymi działaniami w zakresie oceny i monitorowania. Od grudnia 2016 r. Komisja prowadziła prace wspólnie z przedstawicielami państw członkowskich i koordynatorami europejskich sieci referencyjnych nad opracowaniem systemu ciągłego monitorowania przez Komisję i okresowej oceny własnej w odniesieniu do wszystkich członków europejskich sieci referencyjnych. W momencie prowadzenia kontroli nie podjęto jednak jeszcze decyzji, jakie działania należy podjąć, jeśli system monitorowania wskaże na niedociągnięcia u poszczególnych świadczeniodawców. Komisja planuje ponadto przeprowadzić ocenę europejskich sieci referencyjnych z końcem pięcioletniego okresu finansowania41.
W budżecie UE nie wyodrębniono osobnej linii budżetowej na pokrycie kosztów sieci
58Przepisy dyrektywy nakładają na Komisję wymóg wspierania państw członkowskich w rozwijaniu europejskich sieci referencyjnych. W budżecie UE nie wyodrębniono osobnej linii budżetowej na pokrycie kosztów sieci. Aby zapewnić wsparcie działalności sieci, Komisja korzystała ze źródeł finansowania w ramach różnych programów (program w dziedzinie zdrowia, instrument „Łącząc Europę”) i różnych mechanizmów finansowania (zaproszenia do składania wniosków i procedury przetargowe). Komisja nie opracowała kompleksowego planu finansowania na lata 2017–2021 ani nie przekazała go europejskim sieciom referencyjnym i władzy budżetowej.
59W listopadzie 2017 r. Komisja przekazała sieciom kliniczny system zarządzania przypadkami chorobowymi (CPMS) do celów wymiany i udostępniania danych pacjentów (zob. pkt 15). Konsultacje pacjentów przeprowadzane z wykorzystaniem tego systemu stanowią jeden z istotnych aspektów działalności europejskich sieci referencyjnych. Przy okazji konsultacji transgranicznych przeprowadzanych za pośrednictwem CPMS wyniknął jednak problem wynagrodzenia dla lekarzy za czas przeznaczony na diagnozowanie i leczenie pacjentów znajdujących się w innym państwie członkowskim. Na rys. 7 przedstawiono liczbę paneli konsultacyjnych utworzonych w systemie w podziale na poszczególne europejskie sieci referencyjne w okresie od listopada 2017 r. do grudnia 2018 r.
Rys. 7
Panele konsultacyjne jako świadectwo funkcjonowania europejskich sieci referencyjnych

Źródło: sprawozdanie Komisji dotyczące systemu CPMS z grudnia 2018 r.
Każdy koordynator europejskiej sieci referencyjnej otrzymuje obecnie środki unijne w kwocie 1 mln euro na okres pięciu lat42 na pokrycie kosztów administracyjnych. Przy corocznym wypłacaniu europejskim sieciom referencyjnym środków na pokrycie kosztów administracyjnych często występowały opóźnienia. Wyniki badania ankietowego koordynatorów tych sieci przeprowadzonego przez Komisję w styczniu 2018 r., w którym odpowiedzi udzieliło 20 sieci, wskazują, że trwałość finansowania jest jednym z dwóch największych wyzwań, którym muszą one sprostać43. Spośród 24 sieci 17 uwzględniło znalezienie innych źródeł finansowania w swoich celach lub w strategiach ograniczania ryzyka.
61Obok środków na pokrycie kosztów administracyjnych Komisja udostępniła sieciom dotacje, by wspierać ich dążenia do osiągnięcia wyznaczonych celów. Wszczęła postępowania o udzielenie zamówienia w celu opracowania działań na rzecz tworzenia i rozwoju sieci. Działania podjęte do końca 2018 r. dotyczyły:
- wykorzystania rozwiązań z dziedziny e-zdrowia, tj. klinicznego systemu zarządzania przypadkami chorobowymi (łączna kwota przyznanych środków wyniosła 5 mln euro z instrumentu „Łącząc Europę);
- opracowania wytycznych w zakresie praktyk klinicznych (łącznie 4 mln euro z programu w dziedzinie zdrowia);
- rejestrów europejskich sieci referencyjnych (łącznie 2 mln euro na rzecz pięciu europejskich sieci referencyjnych w 2018 r. z programu w dziedzinie zdrowia);
- zapewnienia szkoleń i narzędzi koordynatorom europejskich sieci referencyjnych (zaproszenie do składania ofert wystosowane do przedsiębiorstw zewnętrznych o szacowanej wartości 400 000 euro);
- świadczenia usług sekretariatu dla grupy roboczej koordynatorów europejskich sieci referencyjnych (zaproszenie do składania ofert wystosowane do przedsiębiorstw zewnętrznych o szacowanej wartości 380 000 euro);
- opracowania szablonów dokumentów europejskich sieci referencyjnych (zaproszenie do składania ofert wystosowane do przedsiębiorstw zewnętrznych o szacowanej wartości 100 000 euro).
Koordynatorzy sieci stwierdzili, że uczestnictwo w licznych zaproszeniach do składania wniosków ogłoszonych przez Komisję skutkowało znacznym obciążeniem administracyjnym. Ponadto trwałość rejestrów sieci w długim terminie – obecnie finansowanych ze środków programu w dziedzinie zdrowia – pozostaje pod znakiem zapytania, choć już w komunikacie z 2008 r. w sprawie rzadkich chorób Komisja podkreślała ryzyko związane z finansowaniem rejestrów na zasadzie projektowej.
Komisja uruchamia obecnie – choć z opóźnieniem – ogólnounijną platformę rejestracji rzadkich chorób
63W swoim komunikacie z 2008 r. w sprawie rzadkich chorób Komisja zwróciła uwagę na znaczenie baz danych i rejestrów umożliwiających prowadzenie klinicznych i epidemiologicznych badań nad tymi chorobami. Podkreśliła ponadto znaczenie zapewnienia długoterminowej trwałości tych systemów. W reakcji na ten problem w 2013 r. Wspólne Centrum Badawcze Komisji rozpoczęło prace nad europejską platformą rejestracji rzadkich chorób, współfinansowaną z programu w dziedzinie zdrowia44 i otwartą dla wszystkich europejskich rejestrów rzadkich chorób. Platforma opracowana przez Wspólne Centrum Badawcze ma zaradzić fragmentacji danych przechowywanych w rejestrach pacjentów cierpiących na rzadkie choroby w Europie przez promowanie na szczeblu UE standardów gromadzenia danych oraz przez udostępnianie narzędzi zapewniających interoperacyjność na potrzeby wymiany danych dotyczących tych chorób.
64Trybunał ustalił, że obok platformy opracowywanej przez Wspólne Centrum Badawcze Komisja zapewniła finansowanie na rzecz innego projektu, RD-Connect, ze środków siódmego programu ramowego w dziedzinie badań i innowacji. Jednym z celów projektu RD-Connect było utworzenie wykazu rejestrów pacjentów na potrzeby prowadzenia badań naukowych nad rzadkimi chorobami. Obu projektom przyświecał podobny cel – połączenie rejestrów w UE w celu ułatwienia badaczom dostępu do danych dotyczących rzadkich chorób. W konsekwencji Komisja finansuje projekty, których produkty mogą się pokrywać.
65W momencie przeprowadzania kontroli uruchomienie platformy Wspólnego Centrum Badawczego planowano na luty 2019 r., ponad dwa lata później niż początkowo ustalono. Jednym z powodów opóźnienia był fakt, że opracowanie platformy Wspólnego Centrum Badawczego obejmowało również przekazanie dwóch istniejących sieci45 do Centrum, co wymagało większej ilości zasobów i czasu niż oczekiwano. Trybunał stwierdził, że pierwotny harmonogram i środki budżetowe przewidziane dla platformy były nierealistyczne. Ponadto środki DG ds. Zdrowia i Bezpieczeństwa Żywności przeznaczone dla platformy pokrywają obecnie ok. 45% kosztów prac, ale brak jest rezerw zapewniających trwałe finansowanie i planów pozwalających zagwarantować powodzenie działań platformy (z wyjątkiem planu rozpowszechniania wiedzy sporządzonego w czwartym kwartale 2017 r.).
Wnioski i zalecenia
66Trybunał przeanalizował nadzór Komisji nad transpozycją dyrektywy w sprawie transgranicznej opieki zdrowotnej w państwach członkowskich i dotychczasowe rezultaty w zakresie transgranicznej wymiany danych dotyczących zdrowia. Ocenił również działania UE w dziedzinie polityki dotyczącej rzadkich chorób. Kontrola miała na celu udzielenie odpowiedzi na następujące pytanie:
Czy działania UE w zakresie transgranicznej opieki zdrowotnej przynoszą korzyści pacjentom?
67Trybunał ustalił, że wprawdzie działania UE w zakresie transgranicznej opieki zdrowotnej miały ambitne cele i usprawniły współpracę państw członkowskich, niemniej wymagają one lepszego zarządzania. W momencie przeprowadzania kontroli oddziaływanie tych działań na pacjentów było ograniczone.
68Trybunał stwierdził, że Komisja zapewniła odpowiedni nadzór nad wdrożeniem dyrektywy w państwach członkowskich (pkt 23–28), i wspierała prace krajowych punktów kontaktowych odpowiedzialnych za informowanie pacjentów korzystających z transgranicznej opieki zdrowotnej. Ponadto ostatnio opracowała zestaw praktycznych narzędzi dla tych punktów. Niemniej pacjenci w UE wciąż borykają się z problemami w dostępie do opieki zdrowotnej za granicą. Jedynie niewielka część z nich jest świadoma przysługujących im praw do korzystania z opieki transgranicznej. Złożoność dróg dostępu pacjentów do leczenia w ramach transgranicznej opieki zdrowotnej, które przewidziano w przepisach dyrektywy w sprawie transgranicznej opieki zdrowotnej oraz rozporządzenia w sprawie koordynacji systemów zabezpieczenia społecznego, sprawia, że trudno jest zapewnić pacjentom przejrzyste informacje. Krajowe punkty kontaktowe udostępniają na swoich stronach internetowych niewiele informacji na temat europejskich sieci referencyjnych (pkt 29–32).
Zalecenie 1 – Zapewnienie większego wsparcia na rzecz krajowych punktów kontaktowychKomisja Europejska powinna:
- w oparciu o doświadczenia z wcześniejszych działań wspierać prace krajowych punktów kontaktowych, m.in. w odniesieniu do najlepszych sposobów informowania o różnicach między procedurami w ramach dyrektywy w sprawie transgranicznej opieki zdrowotnej i w ramach rozporządzenia w sprawie systemów zabezpieczenia społecznego;
- zapewnić wytyczne na temat sposobu prezentowania informacji o europejskich sieciach referencyjnych na stronach internetowych krajowych punktów kontaktowych;
- monitorować wykorzystanie przez krajowe punkty kontaktowe zestawu narzędzi z 2018 r.
Termin realizacji: 2020 r.
69W 2018 r. Komisja przyjęła nową strategię w dziedzinie e-zdrowia, nie przeprowadziła jednak aktualizacji obowiązującego planu działania w tej dziedzinie. W strategii z 2018 r. brak jest ustalonego planu wdrażania, w którym określono by terminy uzyskania oczekiwanych rezultatów i produktów (pkt 34–37).
70Prace nad transgraniczną wymianą danych dotyczących zdrowia doprowadziły do opracowania standardów interoperacyjności. Komisja buduje we współpracy z państwami członkowskimi ogólnounijną infrastrukturę na potrzeby tej wymiany danych. Komisja nie oszacowała przy tym prawdopodobnej liczby użytkowników tej infrastruktury przed uruchomieniem projektu, a prognozy dotyczące prawdopodobnego zakresu korzystania z transgranicznej wymiany danych dotyczących zdrowia były nadmiernie optymistyczne. Infrastrukturę w dziedzinie e-zdrowia wdrożono z opóźnieniem. W momencie kontroli nie rozpoczęto jeszcze transgranicznej wymiany danych dotyczących zdrowia za pośrednictwem tej infrastruktury (pkt 38–47).
Zalecenie 2 – Lepsze przygotowanie do transgranicznej wymiany danych dotyczących zdrowiaKomisja Europejska powinna:
- ocenić rezultaty osiągnięte w odniesieniu do transgranicznej wymiany danych dotyczących zdrowia za pośrednictwem ogólnounijnej infrastruktury w dziedzinie e-zdrowia (w zakresie e-recept i elektronicznych kartotek pacjentów);
- w świetle powyższego ocenić plan działania z 2012 r. w dziedzinie e-zdrowia oraz wdrożenie strategii z 2018 r. w tej dziedzinie, w tym ocenić, czy podjęte działania zapewniły terminowe i efektywne kosztowo rozwiązania, a także czy wniosły istotny wkład w funkcjonowanie krajowych systemów opieki zdrowotnej;
Termin realizacji: 2021 r.
Termin realizacji: 2021 r.
Uruchomienie europejskich sieci referencyjnych stanowi ambitną innowację w zakresie współpracy dotyczącej transgranicznej opieki zdrowotnej, szczególnie że opieka zdrowotna należy do kompetencji państw członkowskich. Komisja udostępniła utworzonym sieciom referencyjnym kliniczny system zarządzania przypadkami chorobowymi, tak aby ułatwić wymianę danych dotyczących pacjentów. Sieci utworzono w marcu 2017 r. i jest jeszcze zbyt wcześnie, by ocenić, czy udało się im wnieść wartość dodaną w wysiłki państw członkowskich na rzecz zapewnienia lepszego leczenia pacjentom cierpiącym na rzadkie choroby.
72Trybunał ustalił, że od 2014 r. Komisja nie dokonała pomiarów postępów poczynionych we wdrażaniu unijnej strategii dotyczącej rzadkich chorób (pkt 49–51). Proces tworzenia europejskich sieci referencyjnych oraz bieżące wsparcie Komisji na rzecz tych sieci charakteryzowało się niedociągnięciami. Komisja do tej pory nie określiła planu wydatków przeznaczonych na sieci. Ponadto europejskie sieci referencyjne muszą przezwyciężyć istotne problemy, aby zapewnić sobie trwałe finansowanie i móc skutecznie funkcjonować w obrębie krajowych systemów opieki zdrowotnej i na styku między tymi systemami. W związku z tym Komisja zachęcała państwa członkowskie do włączenia sieci do krajowych systemów opieki zdrowotnej (pkt 52–62). Trybunał stwierdził ponadto, że ogólnounijną platformę rejestrów rzadkich chorób uruchomiono z opóźnieniem (pkt 63–65).
Zalecenie 3 – Poprawa wsparcia na rzecz ułatwienia pacjentom cierpiącym na rzadkie choroby dostępu do opieki zdrowotnejKomisja Europejska powinna:
- ocenić rezultaty osiągnięte w ramach strategii rzadkich chorób (w tym rolę europejskich sieci referencyjnych) i zdecydować, czy strategia ta powinna zostać zaktualizowana, dostosowana lub zastąpiona;
- określić w porozumieniu z państwami członkowskimi, w jaki sposób należy sprostać wyzwaniom stojącym przed europejskimi sieciami referencyjnymi (w tym kwestii włączenia europejskich sieci referencyjnych do krajowych systemów opieki zdrowotnej oraz kwestii rejestrów pacjentów);
- podjąć prace na rzecz uproszczenia struktury wszelkiego przyszłego unijnego finansowania przeznaczonego dla europejskich sieci referencyjnych oraz na rzecz ograniczenia obciążenia administracyjnego sieci.
Termin realizacji: 2023 r.
Termin realizacji: 2020 r.
Termin realizacji: 2022 r.
Niniejsze sprawozdanie zostało przyjęte przez Izbę I, której przewodniczył członek Trybunału Obrachunkowego Nikolaos MILIONIS, na posiedzeniu w Luksemburgu w dniu 10 kwietnia 2019 r.
W imieniu Trybunału Obrachunkowego

Klaus-Heiner LEHNE
Prezes
Załączniki
Załącznik I – Porównanie praw do transgranicznej opieki zdrowotnej przysługujących pacjentom na mocy dyrektywy i na mocy rozporządzenia
| DYREKTYWA | ROZPORZĄDZENIE | |
|---|---|---|
| Sektor | Publiczny + Prywatny | Tylko publiczny |
| Kwalifikujące się świadczenia lecznicze | Świadczenia dostępne w zakresie ubezpieczenia zdrowotnego państwa pochodzenia pacjenta | Świadczenia dostępne w zakresie krajowego ubezpieczenia zdrowotnego obcego państwa |
| Uprzednia zgoda | Wymagana w pewnych okolicznościach | Zawsze wymagana w przypadku zaplanowanego leczenia Niewymagana w sytuacjach nagłych |
| Pokrywane koszty | Zwrot kosztów do takiej samej kwoty, jak w przypadku gdy leczenie przeprowadza się w państwie pochodzenia pacjenta | Całkowita refundacja (z wyjątkiem udziału własnego) |
| Zwrot udziału własnego | Do limitu kosztów obowiązującego w państwie pochodzenia | Tak (w pewnych warunkach) |
| Metoda rozliczenia | Pacjenci opłacają leczenie z góry i otrzymują zwrot kosztów w późniejszym terminie (system zwrotu kosztów) | Między państwami, pacjenci nie muszą opłacać leczenia z góry (system finansowania) |
| Kwalifikujące się państwa | Wszystkie państwa należące do UE i EOG | Wszystkie państwa należące do UE i EOG + Szwajcaria |
Źródło: Europejski Trybunał Obrachunkowy na podstawie strony internetowej „Healthcare beyond borders” [Opieka zdrowotna bez granic].
Załącznik II – Planowane uruchomienie transgranicznej wymiany danych dotyczących zdrowia w UE – aktualna sytuacja

Źródło: Publikacja pt. „Service Catalogue, Delivery and Overall Deployment – eHDSI – ePrescription and Patient Summary” [Katalog usług, osiągnięte wyniki i ogólne wdrożenie – eHDSI – e-recepty i kartoteki] dostępna na stronie internetowej eHDSI46.
Załącznik III – Wykaz europejskich sieci referencyjnych
| Skrócona nazwa | Pełna nazwa |
|---|---|
| Endo-ERN | Europejska sieć referencyjna ds. zaburzeń endokrynologicznych |
| ERKNet | Europejska sieć referencyjna ds. chorób nerek |
| ERN BOND | Europejska sieć referencyjna ds. schorzeń kości |
| ERN CRANIO | Europejska sieć referencyjna ds. anomalii rozwoju twarzoczaszki i zaburzeń laryngologicznych |
| EpiCARE | Europejska sieć referencyjna ds. rzadkich i złożonych przypadków padaczki |
| ERN EURACAN | Europejska sieć referencyjna ds. rzadkich nowotworów u osób dorosłych (guzy lite) |
| EuroBloodNet | Europejska sieć referencyjna ds. rzadkich chorób hematologicznych |
| ERN eUROGEN | Europejska sieć referencyjna ds. chorób i schorzeń układu moczowo-płciowego |
| ERN EURO-NMD | Europejska sieć referencyjna ds. chorób nerwowo-mięśniowych |
| ERN EYE | Europejska sieć referencyjna ds. chorób oczu |
| ERN Genturis | Europejska sieć referencyjna ds. zespołów genetycznego ryzyka rozwoju nowotworu |
| ERN GUARD-Heart | Europejska sieć referencyjna ds. rzadkich i złożonych chorób serca |
| ERN ERNICA | Europejska sieć referencyjna ds. dziedzicznych i wrodzonych zaburzeń |
| ERN ITHACA | Europejska sieć referencyjna ds. wad wrodzonych i rzadkich niepełnosprawności umysłowych |
| ERN LUNG | Europejska sieć referencyjna ds. chorób układu oddechowego |
| ERN TRANSPLANT-CHILD | Europejska sieć referencyjna ds. przeszczepów u dzieci |
| ERN PaedCan | Europejska sieć referencyjna ds. nowotworów u dzieci i młodzieży (hemato-onkologia) |
| ERN RARE-LIVER | Europejska sieć referencyjna ds. chorób hepatologicznych |
| ERN ReCONNET | Europejska sieć referencyjna ds. chorób tkanki łącznej i układu mięśniowo-szkieletowego |
| ERN RITA | Europejska sieć referencyjna ds. niedoboru odporności, chorób autozapalnych i autoimmunologicznych |
| ERN-RND | Europejska sieć referencyjna ds. chorób neurologicznych |
| ERN Skin | Europejska sieć referencyjna ds. rzadkich schorzeń skóry |
| MetabERN | Europejska sieć referencyjna ds. dziedzicznych zaburzeń metabolicznych |
| VASCERN | Europejska sieć referencyjna ds. wielonarządowych chorób naczyniowych |
Wykaz skrótów
CPMS – kliniczny system zarządzania przypadkami chorobowymi
DG SANTE – Dyrekcja Generalna ds. Zdrowia i Bezpieczeństwa Żywności
eHDSI – infrastruktura usług cyfrowych w dziedzinie e-zdrowia
epSOS – projekt dotyczący inteligentnych otwartych usług dla pacjentów europejskich
EUCERD – Komitet Ekspertów Unii Europejskiej do spraw Rzadkich Chorób
JRC – Wspólne Centrum Badawcze Komisji Europejskiej
TFUE – Traktat o funkcjonowaniu UE
Glosariusz
Elektroniczna kartoteka – pełna ewidencja medyczna lub podobna dokumentacja przeszłego i obecnego stanu zdrowia fizycznego i psychicznego danej osoby, przedstawiona w formie elektronicznej i zapewniająca dostępność tych danych na potrzeby leczenia lub innych ściśle związanych z tym celów.
e-Recepta – recepta na leki lub leczenie w formacie elektronicznym wystawiona z wykorzystaniem oprogramowania przez upoważnionego przepisami prawa świadczeniodawcę oraz elektroniczna transmisja danych z recepty do apteki, gdzie lek może zostać wydany.
Europejskie sieci referencyjne – wirtualne sieci zrzeszające świadczeniodawców w dziedzinie opieki zdrowotnej z całej Europy. Mają ułatwić walkę ze złożonymi lub rzadkimi chorobami i schorzeniami, które wymagają wyspecjalizowanego leczenia i zgromadzenia odpowiedniej wiedzy i środków.
e-Zdrowie – wykorzystanie technologii informacyjno-komunikacyjnych w wyrobach, usługach i procedurach medycznych wiążące się ze zmianą organizacji systemów opieki zdrowotnej i nowymi umiejętnościami. e-Zdrowie oznacza świadczenie opieki zdrowotnej środkami elektronicznymi.
Interoperacyjność – zdolność do wzajemnego wykorzystywania i wymiany danych w ramach różnych systemów opieki zdrowotnej, tak aby możliwe było łączenie informacji.
Koordynator europejskiej sieci referencyjnej – w ramach każdej europejskiej sieci referencyjnej jeden z jej członków pełni funkcję koordynatora. Czuwa nad współpracą w ramach sieci.
Rzadka choroba – schorzenie lub chorobę określa się w UE mianem rzadkich, gdy dotykają one mniej niż pięciu osób na 10 000.
Transgraniczna opieka zdrowotna – opieka zdrowotna świadczona lub przepisywana poza granicami państwa, w którym ubezpieczona jest dana osoba.
Przypisy
1 Dyrektywa Parlamentu Europejskiego i Rady 2011/24/UE z dnia 9 marca 2011 r. w sprawie stosowania praw pacjentów w transgranicznej opiece zdrowotnej (Dz.U. L 88 z 4.4.2011, s. 45).
2 Art. 168 Traktatu o funkcjonowaniu Unii Europejskiej (TFUE).
3 Rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 883/2004 z dnia 29 kwietnia 2004 r. w sprawie koordynacji systemów zabezpieczenia społecznego (Dz.U. L 166 z 30.4.2004, s. 1). Rozporządzenie to jest istotne w kontekście świadczenia transgranicznej opieki zdrowotnej w kontekście mobilności pracowników i turystyki oraz powiązań między opieką zdrowotną i systemami zabezpieczenia społecznego w tej dziedzinie.
4 Wskazują na to rezultaty badania ankietowego krajowych punktów kontaktowych przeprowadzonego w maju 2017 r. przez grupę ekspertów ds. transgranicznej opieki zdrowotnej, co dodatkowo potwierdziła ankieta Trybunału przeprowadzona wśród członków wspomnianej grupy ekspertów.
5 Sprawozdanie Komisji dotyczące funkcjonowania dyrektywy 2011/24/UE w sprawie stosowania praw pacjentów w transgranicznej opiece zdrowotnej (COM(2018) 651 final)
6 Załącznik B do sprawozdania Komisji dotyczącego funkcjonowania dyrektywy 2011/24/UE (COM(2018) 651 final).
7 Europejska współpraca terytorialna, znana szerzej jako Interreg, jest jednym z dwóch celów unijnej polityki spójności. Instrument ten ustanawia ramy wspólnych działań i wymiany doświadczeń w zakresie polityki między podmiotami krajowymi, regionalnymi i lokalnymi z różnych państw członkowskich.
8 Badanie Komisji pt. „Study on Cross-Border Cooperation. Capitalising on existing initiatives for cooperation in cross-border regions” [Badanie na temat współpracy transgranicznej – wykorzystanie doświadczeń z dotychczasowych inicjatyw na rzecz współpracy w regionach transgranicznych], opublikowane w marcu 2018 r. Z wykazem projektów i powiązanych celów rozpoznanych we wspomnianym badaniu można zapoznać się tutaj.
9 Komunikat Komisji z dnia 25 kwietnia 2018 r. w sprawie umożliwienia transformacji cyfrowej opieki zdrowotnej i społecznej na jednolitym rynku cyfrowym; wzmacniania pozycji obywateli i budowania zdrowszego społeczeństwa (COM(2018) 233 final). Komunikat sporządzono w wyniku śródokresowego przeglądu strategii jednolitego rynku cyfrowego.
10 Belgia, Czechy, Niemcy, Estonia, Irlandia, Grecja, Hiszpania, Francja, Chorwacja, Włochy, Cypr, Litwa, Luksemburg, Węgry, Malta, Niderlandy, Austria, Polska, Portugalia, Słowenia, Finlandia i Szwecja.
11 Dziesięć państw członkowskich poinformowało, że w 2017 r. zasięg krajowy e-recept przekraczał w ich przypadku 90% (Chorwacja, Czechy, Dania, Estonia, Finlandia, Grecja, Włochy, Portugalia, Hiszpania i Szwecja).
12 Projekt epSOS – dotyczący inteligentnych otwartych usług dla europejskich pacjentów – był finansowany w ramach tematu 3 programu ramowego na rzecz konkurencyjności i innowacji – „Zrównoważone i interoperacyjne usługi opieki zdrowotnej”.
13 Zalecenie Rady z dnia 8 czerwca 2009 r. w sprawie działań w dziedzinie rzadkich chorób.
14 Zarząd państw członkowskich do spraw europejskich sieci referencyjnych utworzono na mocy decyzji wykonawczej Komisji 2014/287/UE z dnia 10 marca 2014 r. w sprawie kryteriów tworzenia i oceny europejskich sieci referencyjnych i ich członków oraz ułatwienia wymiany informacji i wiedzy specjalistycznej w odniesieniu do tworzenia i oceny takich sieci (Dz.U. L 147 z 17.5.2014, s. 79).
15 Strategia Europejskiego Trybunału Obrachunkowego na lata 2018–2020.
16 Dania, Włochy, Litwa, Niderlandy i Szwecja.
17 Dyrektywa wykonawcza Komisji 2012/52/UE z dnia 20 grudnia 2012 r. ustanawiająca środki ułatwiające uznawanie recept lekarskich wystawionych w innym państwie członkowskim (Dz.U. L 356 z 22.12.2012, s. 68).
19 Badania te obejmowały: badanie z 2012 r. w sprawie podejścia opartego na najlepszych praktykach w odniesieniu do stron internetowych krajowych punktów kontaktowych, z zaleceniami dla państw członkowskich i Komisji na temat sposobu zapewnienia za pośrednictwem krajowych punktów kontaktowych odpowiednich informacji dotyczących różnych istotnych aspektów transgranicznej opieki zdrowotnej; badanie z 2014 r. w sprawie wpływu dostępności informacji na decyzje pacjentów w kontekście dyrektywy; badanie oceniające z 2015 r. w sprawie funkcjonowania dyrektywy, w którym zawarto m.in. przegląd stron internetowych krajowych punktów kontaktowych.
20 Zgodnie z rezultatami badania ankietowego krajowych punktów kontaktowych przeprowadzonego przez Komisję na potrzeby sprawozdania w sprawie funkcjonowania dyrektywy.
21 Dokument Komisji pt. „Study on cross-border health services: enhancing information provision to patients” opublikowany 20 lipca 2018 r.
22 Sprawozdanie z dnia 29 stycznia 2019 r. w sprawie wdrażania dyrektywy w sprawie transgranicznej opieki zdrowotnej sporządzone przez Komisję Ochrony Środowiska Naturalnego, Zdrowia Publicznego i Bezpieczeństwa Żywności.
23 Sprawozdanie ze spotkania krajowych punktów kontaktowych z 5 maja 2017 r.
24 Komunikat Komisji z dnia 25 kwietnia 2018 r. w sprawie umożliwienia transformacji cyfrowej opieki zdrowotnej i społecznej na jednolitym rynku cyfrowym; wzmacniania pozycji obywateli i budowania zdrowszego społeczeństwa (COM(2018) 233 final) Komunikat sporządzono w wyniku śródokresowego przeglądu strategii jednolitego rynku cyfrowego.
25 Dokument pt. „Interim evaluation of the eHealth Action Plan 2012–2020” [Śródokresowa ocena planu działania w dziedzinie e-zdrowia na lata 2012–2020], badanie Deloitte przygotowane na zlecenie Komisji.
26 Łączny budżet projektu wyniósł 38 mln euro, z czego UE zgodziła się pokryć w ramach współfinansowania 18 mln euro. Ogółem w projekcie udział wzięły 24 państwa.
27 Kwota ta obejmuje usługi informatyczne na rzecz europejskich sieci referencyjnych.
28 Sprawozdanie z końcowej oceny technicznej usług epSOS z 12 listopada 2014 r.
29 W 2014 r. Dział Systemów Informacyjnych DG ds. Zdrowia i Bezpieczeństwa Żywności przeprowadził ocenę projektu epSOS, aby dokonać przeglądu uzyskanych wyników i osiągniętych postępów oraz podsumować wnioski dotyczące zaawansowania projektu pod kątem ewentualnego dalszego wdrożenia na dużą skalę.
30 Strona internetowa Komisji pn. „Cross-border digital prescription and patient data exchange are taking off” [Transgraniczna wymiana recept cyfrowych i danych dotyczących pacjentów rozpoczyna się na dobre].
31 Strona internetowa Komisji pn. „eHDSI governance” [Zarządzanie eHDSI].
32 Załącznik do rocznego sprawozdania z działalności za 2016 r. – zdrowie i bezpieczeństwo żywności. W swoim rocznym sprawozdaniu z działalności za 2017 r. Komisja podała informację o dziewięciu państwach członkowskich, ponieważ Dania wycofała się z uczestnictwa w transgranicznych usługach informacyjnych w dziedzinie e-zdrowia (zob. pkt 10 oraz ramka 1).
33 Czechy, Estonia, Chorwacja, Luksemburg, Malta, Portugalia i Finlandia.
34 Komunikat Komisji pt. „Rzadkie choroby: wyzwania stojące przed Europą” (COM(2008) 679 final).
35 Zalecenie Rady z dnia 8 czerwca 2009 r. w sprawie działań w dziedzinie rzadkich chorób.
36 Komitet Ekspertów Unii Europejskiej do spraw Rzadkich Chorób ustanowiono na mocy decyzji Komisji Europejskiej 2009/872/WE z dnia 30 listopada 2009 r.
37 Komisja opracowała ramy tych działań w decyzji wykonawczej i decyzji delegowanej z dnia 10 marca 2014 r.
38 W rocznym sprawozdaniu DG ds. Zdrowia i Bezpieczeństwa Żywności za 2016 r. (załącznik A, s. 169) podano cel śródokresowy dziesięciu europejskich sieci referencyjnych w ramach wskaźnika rezultatu 1.5.A – liczba utworzonych europejskich sieci referencyjnych.
39 Art. 4 ust. 5 decyzji wykonawczej Komisji 2014/287/UE
40 Trybunał stwierdził, że w zbadanej próbie 50 sprawozdań z oceny świadczeniodawców z 23 europejskich sieci referencyjnych 30 świadczeniodawców nie przedstawiło informacji na temat przejrzystego planu działania.
41 Art. 14 decyzji wykonawczej Komisji 2014/287/UE z dnia 10 marca 2014 r.
42 Środki pochodzą z trzeciego programu Unii w dziedzinie zdrowia.
43 Zarząd państw członkowskich do spraw europejskich sieci referencyjnych, 6 marca 2018 r.
44 Na podstawie porozumienia administracyjnego między DG ds. Zdrowia i Bezpieczeństwa Żywności i Wspólnego Centrum Badawczego.
45 Chodzi o Europejski Rejestr Wrodzonych Wad Rozwojowych (EUROCAT) oraz Rejestr Mózgowego Porażenia Dziecięcego w Europie (SCPE).
46 W listopadzie 2018 r. sieć e-zdrowie wydała zezwolenia na faktycznie uruchomienie transgranicznej wymiany danych dotyczących zdrowia za pośrednictwem eHDSI czterem państwom członkowskim: Finlandia może przesyłać e-recepty, a Estonia je odbierać. Czechom i Luksemburgowi pozwolono obecnie przyjmować elektroniczne kartoteki z zagranicy, niemniej żadne państwo członkowskie nie może ich przesyłać za pośrednictwem eHDSI. Trzy państwa członkowskie (Chorwacja, Malta i Portugalia) mają zamiar wnioskować o dopuszczenie do uruchomienia wymiany danych w pierwszym kwartale 2019 r.
47 Każde państwo członkowskie uczestniczące w eHDSI otrzymało finansowanie ze środków programu telekomunikacyjnego „Łącząc Europę” na utworzenie krajowego punktu kontaktowego ds. e-zdrowia i rozpoczęcie transgranicznej wymiany danych dotyczących zdrowia. Termin wdrożenia na szczeblu krajowym jest częścią umowy o udzielenie dotacji podpisanej przez poszczególne państwa członkowskie z Komisją.
48 Cztery państwa, które otrzymały zezwolenie na rozpoczęcie działalności przez sieć e-zdrowie w listopadzie 2018 r., planują uruchomienie więcej niż jednej usługi (przesyłanie i przyjmowanie e-recept to dwie różne usługi). (i) Finlandia rozpoczęła przesyłanie e-recept i planuje rozpoczęcie ich przyjmowania do końca 2019 r. (ii) Estonia rozpoczęła przyjmowanie e-recept i planuje rozpoczęcie ich przesyłania do końca 2019 r. (iii) Republika Czeska jest gotowa zarówno do przesyłania, jak i przyjmowania kartotek pacjentów i planuje rozpoczęcie przesyłania i przyjmowania e-recept do końca 2020 r. (iv) Luksemburg jest gotowy do przyjmowania kartotek pacjentów i planuje rozpoczęcie ich przesyłania do końca 2019 r. Planuje również rozpoczęcie przesyłania e-recept do końca 2020 r.
W dniu 11 marca Chorwacja otrzymała pozytywną rekomendację od grupy ekspertów z państw członkowskich ds. e-zdrowia (eHMSEG) dotyczącą uruchomienia wymiany e-recept (zarówno w odniesieniu do przesyłania, jak i przyjmowania) i kartotek pacjentów (w odniesieniu do przyjmowania) po potwierdzeniu przez audytorów pomyślnego wdrożenia ostatniego działania naprawczego. Aby rekomendacja ta stała się skuteczna, musi zostać przyjęta przez sieć e-zdrowia.
49 https://eur-lex.europa.eu/legal-content/PL/TXT/HTML/?uri=CELEX:12012E/TXT&from=PL
50 W szczególności: 1) wnioski z projektu pilotażowego Rare 2030 (Choroby rzadkie 2030) finansowanego przez Parlament Europejski, którego celem jest wspieranie przyszłych decyzji dotyczących polityki, badanie realności nowych podejść oraz proponowanie zaleceń dotyczących polityki (oczekuje się, że wyniki będą dostępne na początku 2021 r.); 2) ocenę trzeciego Programu działań Unii w dziedzinie zdrowia (oczekuje się jej w połowie 2021 r.); 3) ocenę dyrektywy 2011/24/UE w sprawie stosowania praw pacjentów w transgranicznej opiece zdrowotnej (oczekuje się jej przed końcem 2022 r.); 4) ocenę „Horyzont 2020” – programu ramowego w zakresie badań naukowych i innowacji (oczekiwana data do potwierdzenia).
51 https://ec.europa.eu/health/sites/health/files/cross_border_care/docs/2018_crossborder_frep_en.pdf
Zespół kontrolny
Sprawozdania specjalne Trybunału przedstawiają wyniki kontroli dotyczących wybranych obszarów polityki i programów unijnych bądź kwestii związanych z zarządzaniem w wybranych obszarach budżetowych. Trybunał wybiera i opracowuje zadania kontrolne tak, aby osiągnąć jak największe oddziaływanie, biorąc przy tym pod uwagę kryteria takie jak zagrożenia dla wykonania zadań lub zgodności, poziom dochodów lub wydatków w danym obszarze, nadchodzące zmiany oraz interes polityczny i społeczny.
Niniejsza kontrola wykonania zadań została przeprowadzona przez Izbę I, której przewodniczy członek Trybunału Nikolaos Milionis i która zajmuje się wydatkami związanymi ze zrównoważonym użytkowaniem zasobów naturalnych. Kontrolą kierował członek Trybunału Janusz Wojciechowski, a w działania kontrolne zaangażowani byli: Kinga Wiśniewska-Danek, szefowa gabinetu; Katarzyna Radecka-Moroz, attaché; Colm Friel, kierownik; Joanna Kokot, koordynator zadania; Nicholas Edwards, zastępca koordynatora zadania, a także kontrolerzy: Frédéric Soblet, Aris Konstantinidis, Anna Zalega, Michela Lanzutti i Jolanta Zemailaite. Wsparcie językowe zapewnił Mark Smith.

Od lewej: Frédéric Soblet, Kinga Wiśniewska-Danek, Aris Konstantinidis, Janusz Wojciechowski, Colm Friel, Joanna Kokot, Nicholas Edwards, Jolanta Zemailaite.
Kontakt
EUROPEJSKI TRYBUNAŁ OBRACHUNKOWY
12 rue Alcide De Gasperi
1615 Luxembourg
LUKSEMBURG
Tel.: +352 4398-1
Formularz kontaktowy: eca.europa.eu/pl/Pages/ContactForm.aspx
Strona internetowa: eca.europa.eu
Twitter: @EUAuditors
Więcej informacji o Unii Europejskiej można znaleźć w portalu Europa (http://europa.eu).
Luksemburg: Urząd Publikacji Unii Europejskiej, 2019
| ISBN 978-92-847-1933-4 | ISSN 1977-5768 | doi:10.2865/123544 | QJ-AB-19-005-PL-N | |
| HTML | ISBN 978-92-847-1920-4 | ISSN 1977-5768 | doi:10.2865/16794 | QJ-AB-19-005-PL-Q |
© Unia Europejska, 2019
W celu wykorzystania lub powielenia zdjęć lub innych materiałów nieobjętych prawem autorskim Unii Europejskiej należy wystąpić o zgodę bezpośrednio do właścicieli praw autorskich.
JAK SKONTAKTOWAĆ SIĘ Z UE
Osobiście
W całej Unii Europejskiej istnieje kilkaset centrów informacyjnych Europe Direct. Adres najbliższego centrum można znaleźć na stronie: https://europa.eu/european-union/contact_pl.
Telefonicznie lub drogą mailową
Europe Direct to serwis informacyjny, który udziela odpowiedzi na pytania na temat Unii Europejskiej. Można się z nim skontaktować:
- dzwoniąc pod bezpłatny numer telefonu: 00 800 6 7 8 9 10 11 (niektórzy operatorzy mogą naliczać opłaty za te połączenia),
- dzwoniąc pod standardowy numer telefonu: +32 22999696,
- drogą mailową: https://europa.eu/european-union/contact_pl.
Wyszukiwanie informacji o UE
Online
Informacje o Unii Europejskiej są dostępne we wszystkich językach urzędowych UE w portalu Europa: https://europa.eu/european-union/contact_pl.
Publikacje UE
Bezpłatne i odpłatne publikacje UE można pobrać lub zamówić w serwisie EU Bookshop: https://op.europa.eu/pl/publications. Większą liczbę egzemplarzy bezpłatnych publikacji można otrzymać, kontaktując się z serwisem Europe Direct lub z lokalnym centrum informacyjnym (zob. https://europa.eu/european-union/contact_pl).
Prawo UE i powiązane dokumenty
Informacje prawne dotyczące UE, w tym wszystkie unijne akty prawne od 1951 r., są dostępne we wszystkich językach urzędowych UE w portalu EUR-Lex: http://eur-lex.europa.eu/homepage.html?locale=pl.
Portal Otwartych Danych UE
Unijny portal otwartych danych (http://data.europa.eu/euodp) umożliwia dostęp do zbiorów danych pochodzących z instytucji i innych organów UE. Dane można pobierać i wykorzystywać bezpłatnie, zarówno do celów komercyjnych, jak i niekomercyjnych.
 Sprawozdanie specjalne
Sprawozdanie specjalne 