
Medidas da UE relativas aos cuidados de saúde transfronteiriços: ambições importantes, mas é necessária uma melhor gestão
(apresentado nos termos do artigo 287.º, n.º 4, segundo parágrafo, do TFUE)
Sobre o relatório: A Diretiva Cuidados de Saúde Transfronteiriços, de 2011, visa assegurar os direitos dos doentes da UE em matéria de acesso a cuidados de saúde seguros e de elevada qualidade, incluindo através das fronteiras nacionais na UE. Estes direitos destinam-se também a facilitar uma cooperação mais estreita entre os Estados-Membros no domínio da saúde em linha e do tratamento das doenças raras. O Tribunal concluiu que, embora as medidas da UE relativas aos cuidados de saúde transfronteiriços reforcem a colaboração dos Estados-Membros, os benefícios para os doentes foram reduzidos. Além disso, não obstante os progressos realizados no sentido de informar os cidadãos da UE acerca dos cuidados de saúde transfronteiriços, em alguns domínios continua a ser difícil aceder a estas informações. O Tribunal detetou insuficiências no planeamento estratégico e na gestão de projetos pela Comissão e formula recomendações que incidem sobre o apoio da Comissão aos pontos de contacto nacionais, a implantação do intercâmbio transfronteiriço de dados relativos à saúde e as medidas da UE no domínio das doenças raras.
Síntese
IEmbora os cuidados de saúde transfronteiriços continuem a ser uma prática marginal em comparação com os prestados internamente, em alguns casos os cuidados mais acessíveis ou adequados para os doentes estão disponíveis num Estado‑Membro diferente do seu país de origem. A possibilidade de os doentes escolherem de forma livre e esclarecida aceder a cuidados de saúde transfronteiriços pode melhorar os seus cuidados de saúde.
IIA Diretiva Cuidados de Saúde Transfronteiriços, de 2011, visa assegurar o direito dos doentes da UE em matéria de acesso a cuidados de saúde seguros e de elevada qualidade através das fronteiras nacionais na UE, bem como o direito a serem reembolsados por esses serviços. A diretiva facilita uma cooperação mais estreita em vários domínios, nomeadamente o intercâmbio transfronteiriço de dados dos doentes e o acesso aos cuidados de saúde pelos doentes com doenças raras.
IIIAnualmente, cerca de 200 000 doentes usufruem dos sistemas instituídos ao abrigo da diretiva para receberem tratamentos de saúde no estrangeiro, o que representa menos de 0,05 % dos cidadãos da UE. Nos últimos anos, a França comunicou o maior número de doentes que saem e a Espanha o maior número de doentes que entram. Na sua maioria, a mobilidade dos doentes verificou‑se entre Estados‑Membros vizinhos.
IVO Tribunal examinou se a Comissão supervisionou devidamente a execução da diretiva nos Estados‑Membros e se disponibilizou orientações aos pontos de contacto nacionais responsáveis por informar os doentes sobre os seus direitos aos cuidados de saúde transfronteiriços. O TCE avaliou se os resultados obtidos com o intercâmbio transfronteiriço de dados dos doentes estavam em consonância com as expectativas e demonstravam benefícios para os doentes. Examinou igualmente as medidas recentes mais importantes da UE no domínio das doenças raras, incidindo sobre a criação das redes europeias de referência. Estas redes visam partilhar conhecimentos, prestar aconselhamento sobre diagnóstico e tratamento através de consultas virtuais entre os prestadores de cuidados de saúde de toda a Europa e elevar, assim, os padrões de qualidade dos cuidados de saúde.
VO Tribunal conclui que, embora as medidas da UE em matéria de cuidados de saúde transfronteiriços tenham reforçado a cooperação entre os Estados‑Membros, à data da auditoria, o impacto sobre os doentes era reduzido. Estas medidas são ambiciosas e exigem uma melhor gestão.
VIA Comissão supervisionou devidamente a execução da Diretiva Cuidados de Saúde Transfronteiriços. Orientou os pontos de contacto nacionais no sentido de melhorarem as informações sobre cuidados de saúde transfronteiriços, mas continua a existir alguma margem para melhorias.
VIIÀ data da auditoria, não tinha ocorrido nenhum intercâmbio de dados dos doentes entre os Estados‑Membros, pelo que não era possível demonstrar quaisquer benefícios para os doentes transfronteiriços decorrentes destes intercâmbios. A Comissão não definiu um plano de execução que estabelecesse prazos para a sua nova estratégia de saúde em linha nem estimou os volumes de potenciais utilizadores antes da implantação do intercâmbio transfronteiriço de dados relativos à saúde.
VIIIO conceito de redes europeias de referência para doenças raras é amplamente apoiado pelas partes interessadas da UE (organizações de doentes, médicos e prestadores de cuidados de saúde). No entanto, a Comissão não apresentou uma visão clara para o seu futuro financiamento, nem a forma de as desenvolver e integrar nos sistemas nacionais de saúde.
IXCom base nas suas conclusões, o Tribunal formula recomendações que incidem sobre o apoio da Comissão aos pontos de contacto nacionais, a implantação do intercâmbio transfronteiriço de dados relativos à saúde e as medidas da UE no domínio das doenças raras.
Introdução
01A Diretiva Cuidados de Saúde Transfronteiriços (em seguida designada por «diretiva»)1:
- define os direitos dos doentes da UE em matéria de acesso a cuidados de saúde seguros e de elevada qualidade através das fronteiras nacionais na União, bem como o direito a serem reembolsados por esses serviços;
- estabelece pontos de contacto nacionais para informarem os cidadãos sobre os seus direitos a cuidados de saúde transfronteiriços;
- visa facilitar uma cooperação mais estreita em matéria de saúde em linha, incluindo o intercâmbio transfronteiriço de dados dos doentes;
- visa facilitar o acesso dos doentes a cuidados de saúde para doenças raras, designadamente através do desenvolvimento de redes europeias de referência (RER).
Direitos dos doentes em matéria de cuidados de saúde transfronteiriços
02Os cuidados de saúde são da competência nacional e os Estados‑Membros financiam, gerem e organizam os seus sistemas de saúde2. A diretiva estabelece as condições nas quais um doente pode deslocar‑se a outro país da UE para receber tratamentos planeados, que serão reembolsados nas mesmas condições que os tratamentos no seu Estado‑Membro de origem. Abrange os custos dos cuidados de saúde, bem como a prescrição e aquisição de medicamentos e dispositivos médicos, e complementa o quadro jurídico já estabelecido no Regulamento da UE relativo à coordenação dos sistemas de segurança social3 (ver a comparação entre os direitos dos doentes ao abrigo da diretiva e do regulamento no anexo I. A diretiva visa facilitar o acesso a cuidados de saúde transfronteiriços seguros e de elevada qualidade baseado na escolha livre e informada dos doentes, pois em alguns casos os cuidados mais acessíveis ou adequados para os doentes apenas estão disponíveis num Estado‑Membro diferente do seu país de origem. No entanto, a diretiva não incentiva os doentes a receberem tratamento no estrangeiro.
03Os doentes que procurem receber cuidados de saúde noutro Estado‑Membro têm direito a obter informações pertinentes sobre as normas de tratamento e cuidados, as regras de reembolso e a melhor via legal a utilizar. Cada ponto de contacto nacional (PCN) deve disponibilizar essas informações. Os Estados‑Membros podem solicitar uma autorização prévia para certos tipos de cuidados de saúde, sobretudo tratamentos que impliquem um internamento hospitalar ou o recurso a infraestruturas ou equipamentos altamente especializados, o que fazem em cerca de 1 % dos casos.
04A diretiva confirma que os doentes que procurem obter cuidados de saúde no estrangeiro devem ser reembolsados pelo seu país de origem, desde que tenham direito a esses cuidados de saúde no seu país. O nível de reembolso dos tratamentos no estrangeiro é fixado no nível de despesas que teria sido suportado pelo país de origem. O requisito de pagamento antecipado pelos doentes, embora intrínseco à conceção da diretiva, é amplamente reconhecido como um desafio significativo que os doentes enfrentam4. Contudo, a diretiva oferece a possibilidade de os Estados‑Membros apresentarem aos doentes uma estimativa dos custos dos cuidados de saúde.
05O número de cidadãos que solicita o reembolso de cuidados médicos recebidos no estrangeiro ao abrigo da diretiva é reduzido (cerca de 200 000 pedidos por ano, equivalentes a menos de 0,05 % dos cidadãos da UE) em comparação com aqueles que recorrem ao regulamento relativo à coordenação dos sistemas de segurança social (aproximadamente 2 milhões de pedidos por ano relativos a tratamentos não planeados no estrangeiro). Estima‑se que as despesas com cuidados de saúde transfronteiriços ao abrigo da diretiva ascendam a 0,004 % do orçamento anual dos cuidados de saúde na UE5. Um inquérito do Eurobarómetro de 2015 indicou que menos de 20 % dos cidadãos conheciam os seus direitos em matéria de cuidados de saúde transfronteiriços. A Comissão não dispõe de dados recentes sobre o conhecimento dos cidadãos relativamente à diretiva.
06O recurso à diretiva varia consoante os Estados‑Membros. Relativamente aos cuidados de saúde transfronteiriços que não exigem autorização prévia, França tinha o maior número de doentes que saem (cerca de 150 000 em 2016), enquanto Espanha, Portugal e Bélgica tratavam o maior número de doentes que entram6. O quadro 1 mostra a mobilidade dos doentes em todos os países da UE e do Espaço Económico Europeu (EEE) ao abrigo da diretiva em 2016, abrangendo os serviços e os produtos de cuidados de saúde transfronteiriços. Os valores incluem a mobilidade dos doentes tanto para os tratamentos que não exigem autorização prévia (um total de 209 534 doentes) como para os que a exigem (um total de 3 562 doentes).
Quadro 1 — Mobilidade dos doentes ao abrigo da diretiva em 2016
| Doentes que saíram em 2016 | |
|---|---|
| País | Número de doentes |
| FRANÇA | 146 054 |
| DINAMARCA | 25 343 |
| FINLÂNDIA | 11 427 |
| NORUEGA | 10 301 |
| POLÓNIA | 8 647 |
| ESLOVÁQUIA | 6 110 |
| ESLOVÉNIA | 1 835 |
| REINO UNIDO | 1 113 |
| IRLANDA | 791 |
| REPÚBLICA CHECA | 401 |
| LUXEMBURGO | 277 |
| ITÁLIA | 201 |
| CROÁCIA | 200 |
| ROMÉNIA | 130 |
| ESTÓNIA | 80 |
| ISLÂNDIA | 53 |
| BÉLGICA | 30 |
| BÉLGICA | 27 |
| LITUÂNIA | 19 |
| CHIPRE | 13 |
| ESPANHA | 11 |
| GRÉCIA | 10 |
| ÁUSTRIA | 9 |
| BULGÁRIA | 5 |
| PORTUGAL | 5 |
| MALTA | 4 |
| ALEMANHA | sem dados |
| HUNGRIA | sem dados |
| PAÍSES BAIXOS | sem dados |
| SUÉCIA | sem dados |
| Total | 213 096 |
| Doentes que entraram em 2016 | |
|---|---|
| País | Número de doentes |
| ESPANHA | 46 138 |
| PORTUGAL | 32 895 |
| BÉLGICA | 27 457 |
| ALEMANHA | 27 034 |
| LUXEMBURGO | 12 530 |
| REPÚBLICA CHECA | 12 300 |
| ESTÓNIA | 10 044 |
| ITÁLIA | 9 335 |
| POLÓNIA | 6 545 |
| SUÉCIA | 6 162 |
| GRÉCIA | 5 639 |
| HUNGRIA | 4 169 |
| ÁUSTRIA | 2 437 |
| CROÁCIA | 1 680 |
| PAÍSES BAIXOS | 1 653 |
| REINO UNIDO | 1 646 |
| ROMÉNIA | 1 003 |
| BULGÁRIA | 686 |
| IRLANDA | 674 |
| MALTA | 463 |
| FINLÂNDIA | 403 |
| FRANÇA | 371 |
| LITUÂNIA | 369 |
| NORUEGA | 327 |
| ESLOVÁQUIA | 259 |
| CHIPRE | 254 |
| DINAMARCA | 198 |
| LETÓNIA | 167 |
| ISLÂNDIA | 141 |
| ESLOVÉNIA | 117 |
| Total | 213 096 |
Fonte: TCE, com base no documento Report on Member State data on cross‑border patient healthcare following Directive 2011/24/EU — Year 2016 (Relatório sobre os dados dos Estados‑Membros relativos aos cuidados de saúde transfronteiriços na sequência da Diretiva 2011/24/UE — Ano 2016), disponível no sítio Web da Comissão.
07A Comissão apoia a cooperação transfronteiriça no domínio dos cuidados de saúde através de numerosos estudos e iniciativas, incluindo o Interreg7, que são financiados no âmbito dos Fundos Europeus Estruturais e de Investimento. Os Estados‑Membros são responsáveis pela gestão dos seus sistemas de saúde e por eventuais mecanismos de cooperação entre si, que se desenvolvem muitas vezes sem a participação da Comissão. Num estudo recente sobre as atividades e os investimentos da UE na cooperação transfronteiriça nos cuidados de saúde, elaborado pela Comissão, foram identificados 423 projetos financiados pela UE8 de apoio a iniciativas nesse domínio no período de 2007 a 2017.
Intercâmbio transfronteiriço de dados relativos à saúde
08A diretiva mandata a Comissão para apoiar a cooperação entre os Estados‑Membros no domínio da saúde em linha e estabelece uma rede voluntária de autoridades dos Estados‑Membros (rede de saúde em linha) para apoiar a elaboração de normas comuns de transferência de dados no âmbito de cuidados de saúde transfronteiriços. A saúde em linha é também um elemento essencial da Estratégia para o Mercado Único Digital da Comissão Europeia, cujo desenvolvimento na UE está estruturado em torno das ações indicadas nos Planos de Ação da Comissão para a saúde em linha e na estratégia de saúde em linha de 20189. A Comissão criou também um grupo de ação em 2017 que está a analisar os incentivos e os obstáculos que se colocam à concretização do intercâmbio seguro dos dados relativos à saúde em toda a UE.
09A Comissão, juntamente com os Estados‑Membros, está a criar uma infraestrutura de serviços digitais de saúde em linha à escala da UE (eHDSI), a fim de permitir o intercâmbio de dados relativos à saúde dos doentes além das fronteiras nacionais (mais especificamente, as receitas eletrónicas e os historiais dos doentes). Trata‑se de um projeto composto por 22 Estados‑Membros10 com o objetivo de ligar os seus sistemas de saúde em linha à infraestrutura europeia de saúde em linha através de um «portal» específico conhecido como ponto de contacto nacional para a saúde em linha (a figura 1 mostra o procedimento de intercâmbio transfronteiriço de receitas eletrónicas).
Figura 1
Intercâmbio transfronteiriço de uma receita eletrónica

Fonte: TCE.
Em alguns Estados‑Membros11, a utilização das receitas eletrónicas é comum. Outros, porém, só recentemente deram início a projetos‑piloto ou criaram serviços de receitas eletrónicas. A reduzida disponibilidade de serviços de saúde em linha à escala nacional é um dos principais desafios associados à implantação da infraestrutura de saúde em linha à escala da UE. Além disso, alguns Estados‑Membros não participam de todo (por exemplo, a Dinamarca: ver caixa 1 sobre as aplicações de saúde em linha para os doentes) ou apenas participam em alguns dos serviços desta infraestrutura.
Caixa 1
Aplicações de saúde em linha para os doentes na Dinamarca
O portal nacional da saúde em linha, Sundhed.dk (https://www.sundhed.dk), permite aos doentes dinamarqueses acederem aos seus perfis de medicação, verem as consultas marcadas com os prestadores de cuidados de saúde e fazerem novos pedidos de determinados medicamentos. Em 2018, as autoridades dinamarquesas estavam a trabalhar num projeto‑piloto para acrescentar outros elementos ao portal da saúde em linha, a fim de facilitar a marcação das consultas para os doentes que vão a um médico com frequência (por exemplo, doentes crónicos).
Além disso, a aplicação móvel «Medicinkortet» permite que os doentes solicitem a prorrogação das suas atuais receitas eletrónicas. Todas as receitas médicas emitidas na Dinamarca são digitais.
A UE financia a infraestrutura de saúde em linha através do Mecanismo Interligar a Europa (MIE), com base num projeto‑piloto para o intercâmbio transfronteiriço de dados relativos à saúde12. Os Estados‑Membros que pretendem iniciar o intercâmbio transfronteiriço de dados relativos à saúde têm de passar por um processo de testes e auditoria, após o qual um Grupo de Peritos dos Estados‑Membros (eHMSEG) faz uma recomendação. A rede de saúde em linha toma então uma decisão final sobre quais os países que podem tornar operacional o intercâmbio transfronteiriço de dados relativos à saúde.
Iniciativas transfronteiriças para os doentes que sofrem de doenças raras
12A diretiva define uma doença rara como qualquer doença que afete menos de cinco pessoas em cada 10 000. Estima‑se que 6 000 a 8 000 doenças raras afetem entre 6 % e 8 % da população da UE, ou seja, entre 27 milhões e 36 milhões de pessoas. As especificidades das doenças raras (um número reduzido de doentes e escassez de conhecimentos e especialização pertinentes) levaram o Conselho da União Europeia a destacar a cooperação na matéria como «um domínio único de ação, em que a mais‑valia comunitária é muito elevada»13.
13A Comissão apresentou um quadro estratégico específico para combater as doenças raras, designadamente através da criação de redes europeias de referência (RER), na sua comunicação de 2008 sobre «doenças raras: desafios para a Europa». A diretiva determina que a Comissão apoia os Estados‑Membros na criação das RER. A figura 2 mostra os sucessivos desenvolvimentos políticos que levaram à sua criação.
Figura 2
Sucessivos desenvolvimentos políticos que levaram à criação das redes europeias de referência
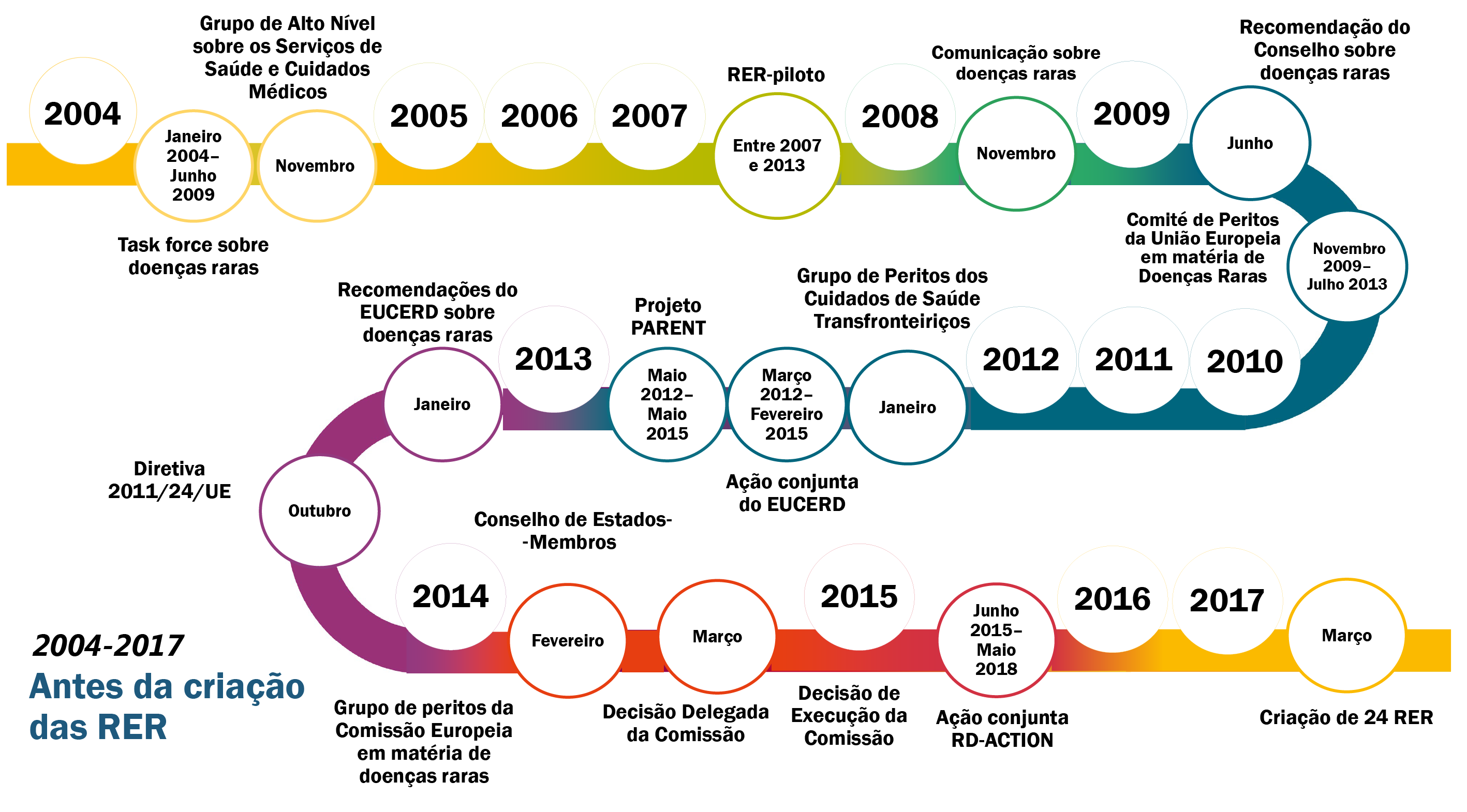
Fonte: TCE.
As RER destinam‑se a acelerar o diagnóstico e a melhorar o acesso a cuidados adequados para os doentes que sofrem de doenças raras, bem como a proporcionar plataformas para a elaboração de orientações, formação e partilha de conhecimentos. Em 2017, foram lançadas 24 redes para diferentes categorias de doenças raras, que recebem financiamento do Programa Saúde da UE no valor de 1 milhão de euros para cada uma ao longo de cinco anos. A Comissão financia igualmente os registos dos doentes e as atividades de apoio das RER, bem como o desenvolvimento de ferramentas informáticas, designadamente através do MIE.
15Quando um processo clínico é transmitido a uma RER, é convocado um painel «virtual» de peritos médicos através do sistema de gestão clínica dos doentes, uma aplicação na Internet disponibilizada pela Comissão em novembro de 2017. A aplicação permite aos médicos partilharem informações, dados e imagens sobre doentes individuais, sujeito ao consentimento destes, e obterem apoio no diagnóstico e tratamento. Até dezembro de 2018, 73 % dos membros das RER estavam registados para utilizar a aplicação e tinham sido criados 333 painéis (a caixa 2 apresenta exemplos de processos de doentes que sofrem de doenças raras consultados pelas RER).
Caixa 2
Exemplos de processos de doentes que sofrem de doenças raras consultados por uma rede europeia de referência
Em 2018, foram apresentados à RER para os cancros pediátricos dois casos de crianças lituanas com um tipo raro de cancro pediátrico que, na sequência dos pareceres de especialistas recebidos através da RER, receberam novos tratamentos.
Em 2017, foi apresentado à RER sobre epilepsias o caso de um menino finlandês de 4 anos com uma anomalia específica do cérebro que provocava uma forma grave de epilepsia. O seu médico na Finlândia consultou os especialistas da RER para obter aconselhamento sobre o tratamento mais adequado. Estiveram envolvidos especialistas de, pelo menos, seis outros países nos debates e na partilha de conhecimentos sobre o tratamento do menino.
Em ambos os casos, as RER prestaram informações valiosas sobre o tratamento dos doentes.
O Conselho de Estados‑Membros das RER14 aprova a criação das redes e os respetivos membros. No final de 2018, havia 952 prestadores de cuidados de saúde (ou seja, institutos e unidades hospitalares) em mais de 300 hospitais que participavam nas RER, repartidos por toda a UE. Nenhuma RER abrangia mais de 19 Estados‑Membros. A figura 3 mostra que a distribuição dos prestadores de cuidados de saúde membros das RER não é uniforme na União, sendo o maior número proveniente de Itália. Este Estado‑Membro tem uma estratégia nacional de longa data em matéria de medidas relativas a doenças raras e uma rede nacional de centros e hospitais especializados qualificados para ajudar os doentes que sofrem de doenças raras.
Figura 3
Distribuição dos prestadores de cuidados de saúde membros das redes europeias de referência na UE

Fonte: TCE, com base em dados fornecidos pela Comissão sobre os prestadores de cuidados de saúde membros de redes europeias de referência por Estado‑Membro, fevereiro de 2019.
Âmbito e método da auditoria
17Um dos objetivos estratégicos do Tribunal de Contas Europeu (TCE) é examinar o desempenho em domínios nos quais a ação da UE seja importante para os cidadãos15. Melhorar as infraestruturas e os serviços de saúde da Europa, bem como a sua acessibilidade e eficácia, é um domínio em que a ação da UE pode acrescentar valor para os seus cidadãos. O Tribunal realizou a sua auditoria 10 anos depois de a Comissão ter aprovado a estratégia em matéria de doenças raras e de ter tido início o projeto‑piloto da UE para o intercâmbio transfronteiriço de dados relativos à saúde. A auditoria do Tribunal procurou dar resposta à seguinte questão:
As medidas da UE em matéria de cuidados de saúde transfronteiriços proporcionam benefícios para os doentes?
18O Tribunal examinou se:
- a Comissão supervisionou devidamente a execução da Diretiva Cuidados de Saúde Transfronteiriços da UE nos Estados‑Membros;
- os resultados alcançados até à data em termos de intercâmbio transfronteiriço de dados relativos à saúde correspondem às expectativas;
- as medidas da UE em matéria de doenças raras acrescentam valor aos esforços dos Estados‑Membros para facilitar o acesso dos doentes a cuidados de saúde transfronteiriços.
A auditoria abrangeu o período desde a adoção da estratégia da Comissão em matéria de doenças raras e o lançamento do principal projeto‑piloto da UE para o intercâmbio transfronteiriço de dados relativos à saúde, em 2008. O Tribunal realizou o trabalho de auditoria entre fevereiro e novembro de 2018, tendo realizado entrevistas com representantes da Direção‑Geral da Saúde e da Segurança dos Alimentos (DG SANTE), da Direção‑Geral das Redes de Comunicação, Conteúdos e Tecnologias e do Centro Comum de Investigação (JRC) da Comissão, bem como com autoridades responsáveis pela aplicação da diretiva em cinco Estados‑Membros16. A escolha dos Estados‑Membros teve em consideração os principais projetos financiados pela UE para o intercâmbio transfronteiriço de dados relativos à saúde.
20O Tribunal realizou ainda um inquérito a todos os representantes dos Estados‑Membros no Grupo de Peritos dos Cuidados de Saúde Transfronteiriços para obter as suas opiniões sobre os principais desenvolvimentos e desafios que prejudicam o acesso dos doentes aos cuidados de saúde transfronteiriços, bem como a representantes da rede de saúde em linha sobre a sua opinião acerca do trabalho da Comissão relativo ao intercâmbio transfronteiriço de dados dos doentes. Foram recebidas 15 respostas do Grupo de Peritos dos Cuidados de Saúde Transfronteiriços e 10 da rede de saúde em linha.
21O Tribunal auditou projetos financiados pela UE que tinham o objetivo de facilitar o acesso aos cuidados de saúde transfronteiriços, incluindo projetos relativos ao intercâmbio transfronteiriço de dados relativos à saúde e outros referentes ao desenvolvimento e à manutenção da Plataforma Europeia para o Registo de Doenças Raras. O Tribunal organizou um painel de peritos para obter aconselhamento independente sobre a política da UE em matéria de doenças raras e as redes europeias de referência.
Observações
A Comissão assegurou que a Diretiva Cuidados de Saúde Transfronteiriços da UE foi posta em prática
22A fim de supervisionar a execução da diretiva, a Comissão deve acompanhar e garantir a sua transposição pelos Estados‑Membros através de controlos da exaustividade e da conformidade. Além disso, a Comissão tem de apresentar um relatório sobre a aplicação da diretiva e orientar devidamente os pontos de contacto nacionais (PCN) responsáveis pela prestação de informações aos doentes sobre os cuidados de saúde transfronteiriços.
A Comissão acompanhou e garantiu a transposição da Diretiva
23Após o prazo para a transposição da diretiva, de 25 de outubro de 2013, e os controlos da exaustividade da transposição pelos Estados‑Membros, a Comissão deu início a 26 procedimentos de infração relativos à comunicação tardia ou incompleta das medidas de transposição. Além disso, deu início a 21 procedimentos de infração relativos à transposição tardia ou incompleta da diretiva de execução relativa ao reconhecimento de receitas médicas emitidas noutro Estado‑Membro17. Depois de todos os Estados‑Membros terem apresentado notificações completas das medidas de transposição, a Comissão encerrou estes procedimentos em novembro de 2017.
24A Comissão verifica a legislação dos Estados‑Membros para determinar se transpuseram corretamente as disposições da diretiva. A fim de orientar estas verificações, a Comissão identificou quatro domínios prioritários que constituem barreiras para os doentes transfronteiriços: os sistemas de reembolso, a utilização da autorização prévia, os requisitos administrativos e a faturação aos doentes que entram. Na sequência destes controlos, a Comissão deu início a 11 processos de infração por sua iniciativa, quatro dos quais estavam encerrados em novembro de 2018, após os Estados‑Membros terem alterado as medidas nacionais de transposição.
25O Tribunal considera que as verificações da Comissão deram origem a melhorias nas práticas e nos sistemas utilizados pelos Estados‑Membros.
A Comissão elaborou relatórios sobre a aplicação da diretiva em tempo oportuno
26A partir de 2015 e de três em três anos, a Comissão tem de elaborar um relatório sobre a aplicação da diretiva18 que deve incluir informações sobre os fluxos de doentes e os custos associados à sua mobilidade. Embora a diretiva não obrigue os Estados‑Membros a recolherem dados sobre fluxos de doentes, especifica que devem prestar à Comissão a assistência e todas as informações disponíveis para a elaboração do relatório. Em 2013, os Estados‑Membros concordaram em fornecer anualmente dados específicos à Comissão.
27A maioria dos Estados‑Membros registou atrasos na adoção das medidas nacionais de transposição (ver ponto 23), o que atrasou o envio de dados à Comissão em 2015. Em 2017, 26 Estados‑Membros apresentaram esses dados que, no entanto, estavam incompletos em seis deles. Além disso, os dados não eram comparáveis entre países, visto que alguns Estados‑Membros comunicaram todos os reembolsos, sem especificar se foram concedidos ao abrigo da diretiva ou do regulamento relativo à coordenação dos sistemas de segurança social. A Comissão reconheceu a pouca exatidão dos dados incluídos nos relatórios em que, por exemplo, a síntese dos fluxos de doentes estava incompleta. O quadro 1 mostra que quatro Estados‑Membros não forneceram dados sobre o fluxo de doentes que saem relativos a 2016.
28Não obstante estas dificuldades, a Comissão cumpriu a sua obrigação de apresentação de relatórios dentro do prazo. Adotou o seu mais recente relatório em setembro de 2018 e apresentou uma síntese dos fluxos de doentes e do impacto financeiro dos cuidados de saúde transfronteiriços ao abrigo da diretiva.
A Comissão orientou os pontos de contacto nacionais no sentido de melhorarem as informações sobre os cuidados de saúde transfronteiriços
29A Comissão apoia e orienta os PCN com o objetivo de disponibilizar informações claras e exaustivas sobre os direitos dos doentes a cuidados de saúde transfronteiriços, tendo, para o efeito, publicado vários estudos relevantes19. Em 2013, antes de terminar o prazo para a transposição da diretiva, a Comissão enviou aos Estados‑Membros uma nota de orientação sobre as vias de tratamento a que os doentes podem recorrer nos cuidados de saúde transfronteiriços: a Diretiva Cuidados de Saúde Transfronteiriços e o regulamento relativo à coordenação dos sistemas de segurança social.
30No entanto, menos de metade dos sítios Web dos PCN explicava as duas formas diferentes de os doentes acederem a cuidados de saúde noutros países20. Em março de 2018, a Comissão procurou resolver a potencial confusão entre os dois atos legislativos mediante a realização de um seminário de reforço das capacidades para os PCN e o desenvolvimento de um conjunto de ferramentas práticas para estes transmitirem as informações aos doentes. O inquérito do Tribunal revelou que as autoridades competentes dos Estados‑Membros acolheram favoravelmente esse conjunto de ferramentas, mas que é necessário continuar a trabalhar para ajudar a explicar a diferença aos doentes.
31Um estudo recente da Comissão21 considerou que as informações à disposição dos doentes nos sítios Web dos PCN eram em geral adequadas e satisfaziam as exigências da diretiva, mas que era possível disponibilizar mais informações sobre os direitos dos doentes que entram e o reembolso dos custos dos cuidados de saúde transfronteiriços dos doentes que saem. Além disso, um relatório sobre a diretiva elaborado pelo Parlamento Europeu salientou que «os sítios Web dos PCN geralmente não dispõem de informação aprofundada sobre os direitos dos doentes»22.
32A diretiva não obriga os PCN a incluir informações sobre as redes europeias de referência (RER) nos seus sítios Web. O Tribunal constatou que alguns deles disponibilizam de facto essas informações e que outros estão a decidir a forma de o fazer. Representantes da Alemanha, da Estónia, da Irlanda, da Lituânia e do Reino Unido já manifestaram interesse em colaborar com o Conselho de Estados‑Membros das RER23. Os especialistas em doenças raras consultados pelo Tribunal consideraram que os PCN devem facultar essas informações sobre as redes.
Intercâmbio transfronteiriço de dados relativos à saúde dos doentes: à data da auditoria, os resultados não correspondiam às elevadas expectativas
33A criação de mecanismos de intercâmbio de dados relativos à saúde dos doentes dentro da UE exige um quadro estratégico e de governação claro, apoiado pelos Estados‑Membros, sendo necessário fixar objetivos claros e acompanhar a execução regularmente. Antes de lançar os projetos em grande escala, a Comissão, com o apoio dos Estados‑Membros, deve estimar os volumes de potenciais utilizadores. É importante retirar ensinamentos dos anteriores projetos‑piloto.
A estratégia de saúde em linha de 2018 não incluía um plano de execução
34Os planos de ação da Comissão para a saúde em linha definem a sua abordagem nesta matéria, incluindo o intercâmbio transfronteiriço de dados relativos à saúde dos doentes. O plano de ação em vigor decorre entre 2012 e 2020. Em abril de 2018, a Comissão adotou uma nova estratégia de saúde em linha24, com um âmbito mais abrangente do que o plano de ação em vigor e que inclui, designadamente, o possível alargamento ao intercâmbio transfronteiriço dos registos de saúde eletrónicos.
35Em 2014, a Comissão publicou uma avaliação intercalar do plano de ação para a saúde em linha25. Embora globalmente positiva, a avaliação salientou algumas insuficiências e recomendou que a Comissão atualize o plano para incluir as questões mais pertinentes, proporcione uma estrutura de governação clara e crie um mecanismo de acompanhamento e coordenação.
36A Comissão executou a maioria das medidas previstas no plano de ação para a saúde em linha. Não deu seguimento à recomendação da avaliação de 2014 no sentido de atualizar o seu plano de ação, nem efetuou uma revisão para refletir a estratégia de saúde em linha de 2018. Por conseguinte, o plano não inclui questões pertinentes, como a introdução do novo Regulamento Geral sobre a Proteção de Dados. Além disso, a Comissão não definiu as responsabilidades pela execução do plano.
37A estratégia de saúde em linha de 2018 refere novos desafios, tais como a introdução do Regulamento Geral sobre a Proteção de Dados e as ameaças à cibersegurança. No entanto, a estratégia não incluiu um plano de execução, com prazos para os resultados e realizações esperados, que demonstraria a abordagem da Comissão para a executar. Quando a Comissão lançou a referida estratégia, em 2018, a única avaliação do seu plano de ação para 2012‑2020 datava de 2014.
A Comissão subestimou as dificuldades envolvidas na implantação da infraestrutura de saúde em linha à escala da UE
38A Comissão tem trabalhado no intercâmbio de dados relativos à saúde de doentes entre Estados‑Membros em duas fases: um projeto‑piloto (epSOS)26, de 2008 a 2012, com um custo de 18 milhões de euros, e um projeto de implantação em curso (infraestrutura de serviços digitais de saúde em linha à escala da UE), com um orçamento de 35 milhões de euros27, lançado em 2015.
39O objetivo do projeto epSOS consistia em desenvolver um quadro e infraestruturas de tecnologias da informação e comunicação para permitir o acesso transfronteiriço seguro às informações sobre a saúde dos doentes. O projeto‑piloto deveria testar a viabilidade funcional, técnica e jurídica, bem como a aceitação da solução proposta para o intercâmbio transfronteiriço de dados relativos à saúde. Pretendia‑se demonstrar a aplicação prática da solução em diversos contextos em vários Estados participantes.
40O projeto desenvolveu as definições do conteúdo dos dados referentes aos historiais dos doentes e às receitas eletrónicas (ver ponto 09), bem como os mecanismos para testar, analisar e aprovar o intercâmbio transfronteiriço de dados relativos à saúde. Contribuiu para o desenvolvimento das especificações e orientações de interoperabilidade da saúde em linha, tendo também disponibilizado normas comuns para promover estes intercâmbios e demonstrado o compromisso dos Estados‑Membros com a cooperação neste domínio.
41A fase de planeamento do projeto não definiu o âmbito e a escala dos testes necessários antes da aplicação prática. Os testes da viabilidade da solução proposta foram compostos por 43 transferências de dados relativos aos doentes, o que significa que o projeto apresentou uma demonstração prática limitada da solução proposta. Na avaliação final do projeto, os avaliadores externos concluíram que o número de historiais dos doentes e de receitas eletrónicas reais era demasiado baixo para que os serviços do projeto epSOS se pudessem considerar operacionais e robustos28. No entanto, a Comissão considerou este intercâmbio, embora limitado, uma prova de conceito suficiente da eHDSI.
42A Comissão avaliou o projeto epSOS em 2014. Nessa avaliação salientava que, embora as expectativas sobre um número estatisticamente relevante de intercâmbios de dados dos doentes não tivessem sido concretizadas no projeto epSOS até àquela data, o conceito do método epSOS para a interoperabilidade transfronteiriça se tinha revelado válido29. Além disso, os problemas de interoperabilidade aos níveis jurídico, organizativo e semântico revelaram ser um desafio maior do que o esperado. A Comissão detetou também declarações de despesas inelegíveis apresentadas pelos contratantes do projeto, na sua maioria associadas aos custos de pessoal. À data da auditoria, a Comissão estava em processo de recuperação das despesas não elegíveis, correspondentes a 42 % do financiamento concedido.
43Apesar destes desafios, a Comissão decidiu, em 2015, utilizar as realizações deste projeto‑piloto como base para o desenvolvimento da infraestrutura de serviços digitais de saúde em linha em grande escala na UE (eHDSI). A arquitetura e as especificações técnicas e semânticas da eHDSI, bem como os acordos jurídicos, organizativos e estratégicos entre os Estados‑Membros participantes, têm por base as concretizações do projeto epSOS.
44O Tribunal detetou insuficiências na preparação da Comissão para este projeto complexo, designadamente a falta de estimativa dos volumes de utilizadores potenciais (doentes e prestadores de cuidados, ou seja, farmácias e hospitais) dos serviços de saúde transfronteiriços em linha que a eHDSI proporciona e uma avaliação insuficiente da relação custo‑eficácia desses serviços antes do lançamento da infraestrutura. Por conseguinte, o Tribunal considera que a Comissão subestimou as dificuldades envolvidas na implantação da infraestrutura de saúde em linha à escala da UE.
A Comissão sobrestimou a probabilidade de aceitação da infraestrutura de serviços digitais de saúde em linha
45Os anúncios da Comissão sobre o nível provável de intercâmbios transfronteiriços de dados relativos à saúde foram demasiado otimistas (ver caixa 3).
Caixa 3
Anúncios da Comissão sobre a aceitação da infraestrutura de saúde em linha à escala da UE
Em dezembro de 2017, a Comissão anunciou que em 2018 doze Estados‑Membros da UE começariam a trocar regularmente dados sobre os doentes30.
No seu sítio Web dedicado à governação da infraestrutura de saúde em linha, a Comissão afirmou esperar que, perto de 2019, o intercâmbio transfronteiriço de dados relativos à saúde na UE começasse a ser uma prática aceite dos sistemas nacionais de saúde31.
Ao avaliar o seu próprio desempenho, a Comissão comunicou em 2017 que dez Estados‑Membros tinham capacidades para o intercâmbio de dados relativos à saúde em linha e para integrar os serviços de informação transfronteiriços nesse domínio32. Este valor baseou‑se na comunicação dos próprios Estados‑Membros em resposta a uma pergunta sobre a criação dos seus portais nacionais de saúde em linha e incluía Estados‑Membros que apenas tinham começado a construir os portais, mas não tinham confirmado a sua disponibilidade para o intercâmbio transfronteiriço de dados relativos à saúde.
À data da auditoria do Tribunal (novembro de 2018), não tinham ainda tido início os intercâmbios transfronteiriços de dados relativos à saúde de doentes através da infraestrutura de saúde em linha da UE (ver o anexo II, que apresenta as datas previstas para a implantação efetiva do intercâmbio transfronteiriço de dados relativos à saúde nos Estados‑Membros). Nessa data, a Comissão tinha avaliado a capacidade de sete Estados‑Membros33 para tornarem operacionais os intercâmbios transfronteiriços. Quatro deles (Chéquia, Estónia, Luxemburgo e Finlândia) tinham sido objeto de controlos de acompanhamento e, em outubro de 2018, o Grupo de Peritos dos Estados‑Membros (eHMSEG) recomendou que ficassem operacionais, desde que todas as medidas corretivas tivessem sido tomadas. A figura 4 apresenta o processo de adesão dos Estados‑Membros aos serviços de informação transfronteiriços sobre saúde em linha e o ponto da situação em 2018.
Figura 4
Processo de adesão aos serviços de informação transfronteiriços sobre saúde em linha — ponto da situação em 2018

Fonte: TCE, com base em informações fornecidas pela Comissão.
O Tribunal constatou igualmente que estes quatro Estados‑Membros foram admitidos na infraestrutura de saúde em linha à escala da UE para explorar diferentes tipos de serviços de saúde em linha. À data da auditoria, a Finlândia estava disponível para enviar receitas eletrónicas, enquanto a Estónia as podia receber (no início de 2019, este era o único intercâmbio de receitas eletrónicas disponível na Europa). Segundo a Comissão, 550 receitas eletrónicas foram tratadas desta forma entre janeiro e o final de fevereiro de 2019. A Chéquia e o Luxemburgo estavam prontos para receber historiais eletrónicos dos doentes do estrangeiro, mas ainda nenhum Estado‑Membro conseguia enviá‑los através da eHDSI. Além disso, no início, apenas alguns prestadores de cuidados de saúde nacionais e farmácias nestes países irão utilizar o sistema. A caixa 4 explica os benefícios que os doentes poderiam retirar dos intercâmbios transfronteiriços de receitas eletrónicas e de historiais eletrónicos dos doentes.
Caixa 4
Intercâmbios transfronteiriços
Receitas eletrónicas (caso da Finlândia e da Estónia)
Quando um doente com uma receita eletrónica emitida na Finlândia se dirige a uma farmácia estónia para comprar os seus medicamentos, esta deve registar a identificação do doente. A farmácia deve depois enviar os dados da receita, com o consentimento do doente, para o portal de saúde em linha da Estónia (o ponto de contacto nacional para a saúde em linha), que deve transmiti‑los ao portal da saúde em linha da Finlândia. Depois de o medicamento ser fornecido ao doente pela farmácia estónia, o portal de saúde em linha finlandês deve ser informado de que a receita eletrónica foi tratada (ver figura 1).
Historiais eletrónicos dos doentes
Quando uma pessoa tem uma urgência médica ou faz uma visita imprevista a um prestador de cuidados de saúde no estrangeiro, o pessoal médico poderia aceder por via eletrónica a informações médicas de base sobre o doente no país de origem deste através do portal da saúde em linha da UE. Os historiais dos doentes podem incluir informações sobre as alergias a medicamentos e facilitar o diagnóstico do doente no estrangeiro.
As redes europeias de referência para doenças raras são uma inovação ambiciosa, mas a sua sustentabilidade não foi demonstrada
48Para ser eficaz, o apoio da Comissão aos Estados‑Membros no desenvolvimento das redes europeias de referência (RER) deve ser prestado no âmbito de um quadro jurídico, com uma estratégia coerente e um roteiro claro.
A Comissão não atualizou o quadro de medidas da UE em matéria de doenças raras
49O desenvolvimento das RER está integrado na política mais vasta da UE sobre doenças raras, que inclui elementos como o apoio ao desenvolvimento de planos nacionais na matéria, a melhoria da normalização da nomenclatura e o apoio à investigação sobre doenças raras. A Comunicação da Comissão de 2008 sobre doenças raras visava «incentivar a cooperação entre os Estados‑Membros e facultar sempre que necessário um apoio à sua ação». O objetivo consistia em definir «uma estratégia comunitária global que ajude os Estados‑Membros»34 na luta contra as doenças raras. O Conselho aprovou esta abordagem na sua Recomendação relativa a uma ação europeia em matéria de doenças raras, de 8 de junho de 200935.
50A Comissão publicou um relatório em 2014 sobre a implementação da Comunicação e da Recomendação do Conselho que conclui que, «de um modo geral, os objetivos da Comunicação e da Recomendação do Conselho foram atingidos». Estes objetivos incluíam o estabelecimento de uma definição clara de doenças raras ou a melhoria da sua codificação nos sistemas de saúde. O relatório adverte que «há ainda um longo caminho a percorrer» para garantir que as pessoas que sofrem de doenças raras em toda a UE obtêm o tratamento de que necessitam e salienta a falta de estratégias de doenças raras em alguns Estados‑Membros como um domínio em que é necessário continuar a trabalhar. O documento enumera 11 ações previstas pela Comissão, incluindo continuar a apoiar a plataforma europeia de doenças raras e o desenvolvimento de planos sobre doenças raras.
51Apesar da conclusão de que os objetivos tinham sido alcançados, nove das 11 ações previstas são uma continuação de iniciativas já existentes. A Comissão não atualizou a sua estratégia em matéria de doenças raras desde 2008, embora gira iniciativas importantes, como as RER e a plataforma para o registo de doenças raras em toda a UE.
A Comissão não aplicou todos os ensinamentos retirados das RER‑piloto
52A Comissão financiou dez RER‑piloto entre 2007 e 2013. O comité consultivo da Comissão sobre Doenças Raras (EUCERD)36 avaliou essas RER‑piloto e, em 2011, publicou um documento intitulado «Preliminary analysis of the outcomes and experiences of pilot European Reference Networks for rare diseases» (Análise preliminar dos resultados e experiências de RER‑piloto para doenças raras). No entanto, quando a Comissão criou as RER, estas apenas deram resposta a algumas das questões suscitadas na avaliação de 2011, por exemplo, o apoio aos registos dos doentes, a necessidade de uma ferramenta específica das tecnologias da informação e comunicação e de cada membro da rede dispor de processos de controlo da qualidade para as suas práticas de prestação de cuidados. As questões pendentes incluem:
- a sustentabilidade das redes após o seu período de financiamento inicial;
- o desenvolvimento de um sistema permanente de acompanhamento e de controlo da qualidade para os membros da rede;
- os desafios administrativos e os custos financeiros de expansão de uma rede;
- o apoio sustentável aos registos dos doentes.
Desde o seu lançamento em 2014, o Conselho de Estados‑Membros das RER tem continuado a trabalhar sobre estes aspetos pendentes e registou progressos relativamente ao acompanhamento permanente e ao controlo da qualidade (tendo para o efeito aprovado, em setembro de 2018, um conjunto de indicadores principais recolhidos pelas RER). No entanto, surgiram novas questões, como a integração das redes nos sistemas nacionais de saúde e a colaboração com o setor, que ainda não foram resolvidas. A figura 5 ilustra os diferentes desafios que se colocam às redes e que a Comissão, o Conselho de Estados‑Membros ou o grupo de coordenadores das redes estão atualmente a tentar resolver.
Figura 5
Desafios ao desenvolvimento de redes europeias de referência

Fonte: TCE, com base nas atas do Conselho de Estados‑Membros das redes europeias de referência.
A Comissão apoiou a criação de 24 redes europeias de referência, mas não criou um sistema eficaz para avaliar os participantes
54A diretiva incumbiu a Comissão de estabelecer condições e critérios específicos que os prestadores de cuidados de saúde devem cumprir a fim de integrar uma RER37. A Comissão recorreu a um consultor para elaborar um conjunto de orientações destinadas aos candidatos e ao organismo de avaliação independente, que avaliou as RER e as candidaturas de cada prestador de cuidados de saúde. A Comissão trabalhou no sentido de aumentar a sensibilização para o lançamento das RER entre as partes interessadas pertinentes e o seu objetivo inicial de apoiar a criação de dez RER38 foi ultrapassado, pois foram criadas 24 (ver uma lista das Redes Europeias de Referência no anexo III).
55A figura 6 ilustra o processo de avaliação das candidaturas dos prestadores de cuidados de saúde à adesão às RER. Antes de apresentar uma candidatura, cada prestador de cuidados de saúde teve primeiro de ser aprovado pela autoridade competente do seu Estado‑Membro. O procedimento de avaliação ao nível da UE limitou‑se a um controlo da elegibilidade das candidaturas e à avaliação de uma amostra de 20 % das mesmas.
Figura 6
Árvore de decisão para a verificação da elegibilidade e o processo de avaliação das candidaturas de adesão dos prestadores de cuidados de saúde às redes europeias de referência

Fonte: análise do TCE com base em documentos fornecidos pela Agência de Execução para os Consumidores, a Saúde, a Agricultura e a Alimentação.
O organismo de avaliação independente elaborou 62 relatórios preliminares negativos. Em todos estes casos, os candidatos apresentaram observações39 sobre as questões pendentes, que permitiram ao organismo de avaliação formular uma apreciação positiva. Contudo, o exame de uma amostra40 dos relatórios de avaliação realizado pelo Tribunal permitiu constatar que, em muitos casos, o organismo de avaliação atribuiu a sua apreciação positiva final com base em informações incompletas. O resultado final do processo de avaliação foi a aceitação nas RER de 952 dos 953 prestadores de cuidados de saúde que se candidataram. O Tribunal conclui que, na prática, este processo de avaliação acrescentou pouco valor à criação das RER.
57O sistema de avaliação baseado na amostragem não era, inicialmente, complementado por outras medidas de acompanhamento ou avaliação. A Comissão tem colaborado com os representantes dos Estados‑Membros e os coordenadores das RER desde dezembro de 2016 para o desenvolvimento de um sistema de acompanhamento permanente pela Comissão e de autoavaliação periódica para todos os membros das RER. No entanto, à data da auditoria, ainda não tinham decidido quais as medidas a tomar caso este sistema de acompanhamento detete prestadores de cuidados de saúde com fraco desempenho. Além disso, a Comissão tenciona avaliar as RER no final do período de financiamento de cinco anos41.
O orçamento da UE não contém uma rubrica orçamental específica para as despesas das redes europeias de referência
58A diretiva exige que a Comissão apoie os Estados‑Membros na criação das RER. O orçamento da UE não contém uma rubrica orçamental específica para as despesas destas redes pelo que, para apoiar o seu funcionamento, a Comissão concedeu financiamento a partir de diferentes programas de despesas (Programa Saúde, MIE) e mediante diferentes mecanismos de despesas (convites à apresentação de propostas e concursos). A Comissão não desenvolveu um plano de financiamento abrangente para o período de 2017‑2021 a transmitir às RER e à autoridade orçamental.
59Em novembro de 2017, a Comissão disponibilizou às redes o sistema de gestão clínica dos doentes, com vista à partilha e consulta dos dados dos doentes (ver ponto 15). A utilização deste sistema nas consultas dos doentes constitui um dos aspetos importantes do funcionamento das RER. No entanto, a realização de consultas transfronteiriças através do sistema de gestão clínica dos doentes salientou a questão do reconhecimento do tempo despendido pelos médicos a diagnosticar e tratar doentes noutro Estado‑Membro. A figura 7 mostra o número de painéis de consulta criados no sistema por RER entre novembro de 2017 e dezembro de 2018.
Figura 7
Os painéis de consulta são um sinal do funcionamento das RER

Fonte: relatório da Comissão sobre o sistema de gestão clínica dos doentes, dezembro de 2018
Cada coordenador das RER recebe atualmente financiamento da UE42 no valor de 1 milhão de euros ao longo de um período de cinco anos para cobrir os custos administrativos, tendo‑se verificado frequentemente atrasos no pagamento deste financiamento administrativo anual às RER. Um inquérito da Comissão aos coordenadores das RER, realizado em janeiro de 2018 e ao qual responderam 20 das redes, mostrou que a sustentabilidade do financiamento é um dos dois principais desafios com que estas se deparam43. Das 24 RER, 17 incluíram a identificação de outras fontes de financiamento nos seus objetivos ou estratégias de atenuação dos riscos.
61Além do financiamento administrativo, a Comissão concedeu subvenções às RER para apoiar a concretização dos seus objetivos, tendo lançado procedimentos de contratação para desenvolver atividades de apoio à criação e ao desenvolvimento das redes. Até ao final de 2018, contavam‑se entre estas:
- a utilização de soluções de saúde em linha, ou seja, o sistema de gestão clínica dos doentes (5 milhões de euros afetados a partir do fundo do MIE);
- elaboração de orientações de prática clínica (no total, 4 milhões de euros provenientes do Programa Saúde);
- registos das RER (no total, 2 milhões de euros para cinco RER em 2018 a partir do Programa Saúde);
- formação e ferramentas para os coordenadores das RER (concurso público para uma empresa externa com valor estimado de 400 000 euros);
- prestação de serviços de secretariado ao grupo de trabalho dos coordenadores das RER (concurso público para uma empresa externa com valor estimado de 380 000 euros);
- elaboração de modelos dos documentos das RER (concurso público para uma empresa externa com valor estimado de 100 000 euros).
Os coordenadores das RER consideram que a participação nos numerosos convites à apresentação de propostas lançados pela Comissão impôs encargos administrativos significativos. Além disso, a sustentabilidade a longo prazo dos registos das RER, atualmente financiados pelo Programa Saúde, não é clara, apesar de a Comissão ter salientado o risco do financiamento dos registos com base em projetos na sua Comunicação de 2008 sobre doenças raras.
Apesar dos atrasos, a Comissão está agora a lançar uma plataforma europeia para o registo das doenças raras
63Na sua Comunicação de 2008 sobre doenças raras, a Comissão destacou a importância das bases de dados e dos registos para permitir a investigação epidemiológica e clínica sobre doenças raras, tendo salientado igualmente a importância de assegurar a sustentabilidade a longo prazo destes sistemas. Em resposta a este desafio, em 2013 o JRC começou a desenvolver a Plataforma Europeia para o Registo de Doenças Raras, cofinanciada pelo Programa Saúde44 e aberta a todos os registos europeus de doenças raras. A plataforma do JRC visa corrigir a fragmentação dos dados contidos nos registos de doentes que sofrem de doenças raras em toda a Europa mediante a promoção de normas à escala da UE para a recolha de dados e a disponibilização de ferramentas de interoperabilidade para o intercâmbio de dados sobre doenças raras.
64O Tribunal constatou que, em paralelo com a plataforma do JRC, a Comissão financiou outro projeto, RD‑Connect, a partir do programa de financiamento da investigação e inovação (Sétimo Programa‑Quadro), que tinha entre os seus objetivos o de criar um inventário de registos de doentes para a investigação sobre doenças raras. Ambos os projetos visam, de forma semelhante, a ligação entre os registos na UE para facilitar aos investigadores o acesso a dados sobre doenças raras. Por conseguinte, a Comissão está a financiar dois projetos com resultados potencialmente sobrepostos.
65À data da auditoria, previa‑se que a plataforma do JRC entrasse em funcionamento em fevereiro de 2019, mais de dois anos após a data inicialmente prevista. Um dos motivos do atraso foi o facto de o seu desenvolvimento incluir igualmente a transferência de duas redes existentes45 para o JRC, o que exigiu mais tempo e recursos do que o previsto. O Tribunal constatou que o calendário e a dotação orçamental inicialmente previstos para a plataforma não eram realistas. Além disso, o financiamento que lhe foi concedido pela DG SANTE abrange atualmente cerca de 45 % dos custos dos trabalhos, mas não existe qualquer disposição relativa à sustentabilidade financeira da plataforma nem planeamento para garantir que esta tenha êxito, além de um plano de divulgação elaborado no quarto trimestre de 2017.
Conclusões e recomendações
66O Tribunal examinou a supervisão pela Comissão da transposição da Diretiva Cuidados de Saúde Transfronteiriços nos Estados‑Membros e os resultados obtidos até à data no intercâmbio transfronteiriço de dados relativos à saúde. O Tribunal avaliou igualmente as medidas da UE no domínio das doenças raras, tendo procurado dar resposta à seguinte questão:
As medidas da UE em matéria de cuidados de saúde transfronteiriços proporcionam benefícios para os doentes?
67O Tribunal conclui que, embora as medidas da UE em matéria de cuidados de saúde transfronteiriços fossem ambiciosas e tivessem reforçado a colaboração dos Estados‑Membros, exigem uma melhor gestão. O impacto nos doentes era reduzido à data da auditoria.
68O Tribunal constatou que a Comissão supervisionou devidamente a execução da diretiva nos Estados‑Membros (pontos 23 a 28), apoiou o trabalho dos pontos de contacto nacionais (PCN) responsáveis pela disponibilização de informações aos doentes transfronteiriços e, recentemente, desenvolveu um conjunto de ferramentas práticas para os PCN. No entanto, os doentes da UE continuam a deparar‑se com problemas no acesso aos cuidados de saúde no estrangeiro e apenas uma minoria dos potenciais doentes conhece os seus direitos de recorrer a cuidados de saúde transfronteiriços. A complexidade das vias de tratamento a que os doentes podem recorrer ao abrigo da Diretiva Cuidados de Saúde Transfronteiriços e do regulamento relativo à coordenação dos sistemas de segurança social torna difícil prestar informações claras aos doentes. Os PCN disponibilizam poucas informações sobre as RER nos seus sítios Web (pontos 29 a 32).
Recomendação 1 — Prestar mais apoio aos pontos de contacto nacionaisA Comissão deve:
- com base nas anteriores medidas, apoiar o trabalho dos pontos de contacto nacionais, incluindo sobre a melhor forma de comunicar a relação entre as vias de tratamento da Diretiva Cuidados de Saúde Transfronteiriços e do regulamento relativo à coordenação dos sistemas de segurança social;
- disponibilizar orientações sobre a apresentação de informações acerca das redes europeias de referência nos sítios Web dos pontos de contacto nacionais;
- acompanhar a utilização do conjunto de ferramentas de 2018 pelos pontos de contacto nacionais.
Prazo de execução: 2020
69Em 2018, a Comissão adotou uma nova estratégia de saúde em linha, sem atualizar o plano de ação em vigor nessa matéria. Essa estratégia não inclui um plano de execução que estabeleça prazos para os resultados e realizações esperados (pontos 34 a 37).
70Os trabalhos sobre o intercâmbio transfronteiriço de dados relativos à saúde deram origem à criação de normas de interoperabilidade. A Comissão, em cooperação com os Estados‑Membros, está a desenvolver uma infraestrutura à escala da UE para estes intercâmbios, mas não estimou o número provável de utilizadores da infraestrutura de saúde em linha à escala da UE antes do lançamento do projeto. As suas previsões da probabilidade de aceitação de intercâmbios transfronteiriços de dados relativos à saúde eram demasiado otimistas. Verificaram‑se atrasos na implantação da infraestrutura de saúde em linha e, à data da auditoria do Tribunal, ainda não tinham tido início os intercâmbios transfronteiriços de dados relativos à saúde através dessa infraestrutura (pontos 38 a 47).
Recomendação 2 — Melhor preparação para o intercâmbio transfronteiriço de dados relativos à saúdeA Comissão deve:
- avaliar os resultados obtidos no intercâmbio transfronteiriço de dados relativos à saúde através da infraestrutura de saúde em linha à escala da UE (receitas eletrónicas e historiais eletrónicos dos doentes);
- à luz destes resultados, avaliar o plano de ação de 2012 para a saúde em linha e a execução da estratégia de saúde em linha de 2018, incluindo uma avaliação sobre se estas medidas proporcionaram soluções oportunas e eficazes em termos de custos e deram um contributo significativo para os sistemas nacionais de saúde.
Prazo de execução: 2021
Prazo de execução: 2021
O lançamento das RER é uma inovação ambiciosa na cooperação em matéria de cuidados de saúde transfronteiriços, em especial tendo em conta que os cuidados de saúde são da competência dos Estados‑Membros. A Comissão disponibilizou o sistema de gestão clínica dos doentes às RER para facilitar a partilha de dados dos doentes. Estas redes foram criadas em março de 2017 e é demasiado cedo para avaliar o seu êxito quanto ao valor que acrescentam aos esforços dos Estados‑Membros no sentido de prestarem melhor assistência aos doentes que sofrem de doenças raras.
72O Tribunal constatou que a Comissão não avaliou os progressos efetuados na execução da estratégia da UE em matéria de doenças raras desde 2014 (pontos 49 a 51). O processo de criação das RER e o apoio continuado da Comissão foram marcados por insuficiências e a Comissão não elaborou um plano de financiamento abrangente para as redes. Estas enfrentam desafios significativos para assegurar que são financeiramente sustentáveis e capazes de funcionar de forma eficaz dentro dos sistemas nacionais de saúde e entre estes. Por conseguinte, a Comissão incentivou os Estados‑Membros a integrarem as RER nos sistemas nacionais de saúde (pontos 52 a 62). O Tribunal constatou igualmente que se registaram atrasos no lançamento da plataforma europeia para o registo das doenças raras (pontos 63 a 65).
Recomendação 3 — Melhorar o apoio para facilitar o acesso dos doentes que sofrem de doenças raras a cuidados de saúdeA Comissão deve:
- avaliar os resultados da estratégia em matéria de doenças raras (incluindo a função das redes europeias de referência) e decidir se essa estratégia necessita de ser atualizada, adaptada ou substituída;
- em consulta com os Estados‑Membros, definir o caminho a seguir para resolver os desafios enfrentados pelas redes europeias de referência (incluindo a integração dessas redes nos sistemas nacionais de saúde e os registos de doentes);
- trabalhar no sentido de simplificar a estrutura de atribuição de financiamento futuro da UE às redes europeias de referência e de reduzir os seus encargos administrativos.
Prazo de execução: 2023
Prazo de execução: 2020
Prazo de execução: 2022
O presente Relatório foi adotado pela Câmara I, presidida por Nikolaos MILIONIS, Membro do Tribunal de Contas, no Luxemburgo, na sua reunião de 10 de abril de 2019.
Pelo Tribunal de Contas

Klaus‑Heiner Lehne
Presidente
Anexos
Anexo I — Comparação dos direitos dos doentes a cuidados de saúde transfronteiriços ao abrigo da diretiva e do regulamento
| DIRETIVA | REGULAMENTO | |
|---|---|---|
| Setor | Público e privado | Apenas público |
| Tratamentos elegíveis | Tratamentos disponíveis no âmbito do seguro de doença do país de origem dos doentes | Tratamentos disponíveis no âmbito do seguro de doença nacional do outro país |
| Autorização prévia | Exigida em determinadas circunstâncias | Sempre exigida para cuidados planeados Não exigida para situações de emergência |
| Despesas cobertas | Reembolso até ao montante do tratamento se este tivesse sido realizado no país de origem do doente | Financiamento integral (salvo as taxas moderadoras) |
| Reembolso de taxas moderadoras | Até ao limite dos custos no país de origem | Sim (em determinadas condições) |
| Método de pagamento | Os doentes pagam antecipadamente e são reembolsados numa data posterior (sistema de reembolso) | Entre países, não é exigido pagamento antecipado aos doentes (sistema de financiamento) |
| Países elegíveis | Todos os países da UE e do EEE | Todos os países da UE e do EEE e a Suíça |
Fonte: TCE, com base no sítio Web «Healthcare beyond borders» (Cuidados de saúde além-fronteiras).
Anexo II — Ponto da situação da implantação prevista do intercâmbio transfronteiriço de dados relativos à saúde na UE

Fonte: documento «Service Catalogue, Delivery and Overall Deployment – eHDSI – ePrescription and Patient Summary» (Catálogo de serviços, concretização e implantação global – eHDSI – receitas eletrónicas e historiais dos doentes) disponível no sítio Internet eHDSI46.
Anexo III — Lista das redes europeias de referência
| Designação abreviada da RER | Designação completa da RER |
|---|---|
| Endo‑ERN | RER para as doenças endócrinas |
| ERKNet | RER para as doenças renais |
| ERN BOND | RER para as doenças ósseas |
| ERN CRANIO | RER para as anomalias craniofaciais e doenças ORL |
| EpiCARE | RER sobre epilepsias |
| ERN EURACAN | RER sobre cancros em adultos (tumores sólidos) |
| EuroBloodNet | RER para as doenças hematológicas |
| ERN eUROGEN | RER para as doenças e patologias urogenitais |
| ERN EURO‑NMD | RER para as doenças neuromusculares |
| ERN EYE | RER sobre doenças oculares |
| ERN Genturis | RER para as síndromes genéticas de risco de tumor |
| ERN GUARD‑Heart | RER para as doenças cardíacas |
| ERN ERNICA | RER para as anomalias hereditárias e congénitas |
| ERN ITHACA | RER para as malformações congénitas e deficiências intelectuais raras |
| ERN LUNG | RER para as doenças respiratórias |
| ERN TRANSPLANT‑CHILD | RER para os transplantes pediátricos |
| ERN PaedCan | RER para os cancros pediátricos |
| ERN RARE‑LIVER | RER para as doenças hepáticas |
| ERN ReCONNET | RER para as doenças músculo-esqueléticas e dos tecidos conjuntivos |
| ERN RITA | RER para a imunodeficiência e as doenças autoinflamatórias e autoimunes |
| ERN‑RND | RER para as doenças neurológicas |
| ERN Skin | RER para as doenças da pele |
| MetabERN | RER para as doenças metabólicas hereditárias |
| VASCERN | RER para as doenças vasculares multissistémicas |
Siglas e acrónimos
DG SANTE: Direção‑Geral da Saúde e da Segurança dos Alimentos
eHDSI: Infraestrutura de serviços digitais de saúde em linha
eHMSEG: Grupo de Peritos dos Estados‑Membros para a eHDSI
epSOS: Serviços inteligentes e abertos para os doentes europeus
EUCERD: Comité de Peritos da União Europeia em matéria de Doenças Raras
JRC: Centro Comum de Investigação da Comissão Europeia
MIE: Mecanismo Interligar a Europa
PCN: Ponto de Contacto Nacional
RAA: Relatório Anual de Atividades
RER: Rede europeia de referência
TFUE: Tratado sobre o Funcionamento da União Europeia
Glossário
Coordenador da RER: um dos membros de cada RER atua como coordenador e facilita a cooperação entre os membros da rede.
Cuidados de saúde transfronteiriços: cuidados de saúde prestados ou prescritos fora do país de afiliação do segurado.
Doença rara: uma doença ou perturbação é considerada rara na UE quando afeta menos de 5 em cada 10 000 pessoas.
Interoperabilidade: capacidade de utilizar e trocar dados entre os diferentes sistemas de saúde a fim de interligar as informações.
Receita eletrónica: receita de medicamentos ou tratamentos, em formato eletrónico, através da utilização de software por um profissional de saúde legalmente autorizado, e a transmissão eletrónica de dados relativos à receita a uma farmácia que disponibiliza então o medicamento.
Redes europeias de referência (RER): redes virtuais que reúnem prestadores de cuidados de saúde de toda a Europa. Visam fazer face a doenças e afeções complexas ou raras que exigem tratamentos altamente especializados e uma concentração de conhecimentos e recursos.
Registo de saúde eletrónico: registo médico completo ou documentação equivalente, em formato eletrónico, dos antecedentes e do estado de saúde atual, físico e mental, de uma pessoa, que permite obter prontamente estes dados para fins de tratamento médico e outros, estreitamente conexos.
Saúde em linha: utilização das tecnologias da informação e comunicação nos produtos, serviços e processos de saúde, combinada com uma mudança organizativa nos sistemas de saúde e novas competências. A saúde em linha corresponde à transferência de cuidados de saúde por via eletrónica.
Notas
1 Diretiva 2011/24/UE do Parlamento Europeu e do Conselho, de 9 de março de 2011, relativa ao exercício dos direitos dos doentes em matéria de cuidados de saúde transfronteiriços (JO L 88 de 4.4.2011, p. 45).
2 Artigo 168.º do Tratado sobre o Funcionamento da União Europeia (TFUE).
3 Regulamento (CE) n.º 883/2004 do Parlamento Europeu e do Conselho, de 29 de abril de 2004, relativo à coordenação dos sistemas de segurança social (JO L 166 de 30.4.2004, p. 1). Este regulamento é relevante para os cuidados de saúde transfronteiriços no contexto da mobilidade laboral e do turismo e das suas ligações com os sistemas de saúde e de segurança social.
4 De acordo com os resultados do inquérito aos PCN realizado pelo Grupo de Peritos dos Cuidados de Saúde Transfronteiriços em maio de 2017 e confirmados pelo inquérito do TCE aos membros desse Grupo de Peritos.
5 Relatório da Comissão sobre a aplicação da Diretiva 2011/24/UE relativa ao exercício dos direitos dos doentes em matéria de cuidados de saúde transfronteiriços, COM(2018) 651 final.
6 Anexo B do Relatório da Comissão sobre a aplicação da Diretiva 2011/24/UE, COM(2018) 651 final.
7 A Cooperação Territorial Europeia (CTE), mais conhecida por Interreg, é um dos dois objetivos da política de coesão da UE e proporciona um quadro para ações conjuntas e intercâmbios de políticas entre intervenientes nacionais, regionais e locais de diferentes Estados-Membros.
8 Study on Cross Border Cooperation. Capitalising on existing initiatives for cooperation in cross border regions (Estudo sobre a cooperação além-fronteiras: tirar partido das iniciativas de cooperação existentes em regiões fronteiriças) — estudo da Comissão publicado em março de 2018. A lista de projetos incluídos no estudo e respetivos objetivos pode ser consultada online aqui.
9 Comunicação da Comissão, de 25 de abril de 2018, sobre a viabilização da transformação digital dos serviços de saúde e de prestação de cuidados no Mercado Único Digital, a capacitação dos cidadãos e a construção de uma sociedade mais saudável, COM(2018) 233 final. A comunicação resultou da revisão intercalar da Estratégia para o Mercado Único Digital.
10 Bélgica, Chéquia, Alemanha, Estónia, Irlanda, Grécia, Espanha, França, Croácia, Itália, Chipre, Lituânia, Luxemburgo, Hungria, Malta, Países Baixos, Áustria, Polónia, Portugal, Eslovénia, Finlândia e Suécia.
11 Dez Estados-Membros declararam uma cobertura nacional superior a 90 % para as receitas eletrónicas em 2017 (Croácia, República Checa, Dinamarca, Estónia, Finlândia, Grécia, Itália, Portugal, Espanha e Suécia).
12 O projeto epSOS, Smart Open Service for European Patients (Serviços inteligentes e abertos para os doentes europeus), financiado no âmbito do tema 3 do Programa Quadro para a Competitividade e a Inovação (PCI): serviços de saúde sustentáveis e interoperáveis.
13 Recomendação do Conselho, de 8 de junho de 2009, relativa a uma ação europeia em matéria de doenças raras
14 O Conselho de Estados-Membros das RER foi criado pela Decisão de Execução 2014/287/UE da Comissão, de 10 de março de 2014, que define critérios para a criação e avaliação de redes europeias de referência e dos seus membros, bem como para facilitar o intercâmbio de informações e experiências sobre a criação e avaliação das referidas redes (JO L 147 de 17.5.2014, p. 79).
15 Estratégia do TCE para 2018-2020.
16 Dinamarca, Itália, Lituânia, Países Baixos e Suécia.
17 Diretiva de Execução 2012/52/UE da Comissão, de 20 de dezembro de 2012, que estabelece medidas para facilitar o reconhecimento de receitas médicas emitidas noutro Estado Membro (JO L 356 de 22.12.2012, p. 68).
19 Esses estudos incluem os seguintes: Estudo de 2012 sobre uma abordagem baseada nas melhores práticas para os sítios Web dos PCN, com recomendações aos Estados-Membros e à Comissão sobre a forma de disponibilizar as informações adequadas sobre vários aspetos essenciais dos cuidados de saúde transfronteiriços através dos PCN; Estudo de 2014 sobre o impacto das informações sobre a escolha dos doentes no contexto da diretiva; Estudo de 2015 de avaliação da aplicação da diretiva que contém, entre outros elementos, uma análise dos sítios Web dos PCN.
20 De acordo com um inquérito aos PCN realizado pela Comissão para o seu relatório sobre a aplicação da diretiva.
21 Commission study on cross border health services: enhancing information provision to patients (Estudo da Comissão sobre serviços de saúde transfronteiriços: reforçar a prestação de informações aos doentes), publicado em 20 de julho de 2018.
22 Relatório sobre a aplicação da Diretiva relativa aos cuidados de saúde transfronteiriços, de 29 de janeiro de 2019, da Comissão do Ambiente, da Saúde Pública e da Segurança Alimentar.
23 Ata da reunião dos PCN de 5 de maio de 2017.
24 Comunicação da Comissão, de 25 de abril de 2018, sobre a viabilização da transformação digital dos serviços de saúde e de prestação de cuidados no Mercado Único Digital, a capacitação dos cidadãos e a construção de uma sociedade mais saudável, COM(2018) 233 final. A comunicação resultou da revisão intercalar da Estratégia para o Mercado Único Digital.
25 Interim evaluation of the eHealth Action Plan 2012-2020 (Avaliação intercalar do plano de ação para a saúde em linha 2012-2020), estudo elaborado pela Deloitte para a Comissão.
26 O orçamento total do projeto era de 38 milhões de euros, dos quais a UE acordou cofinanciar 18 milhões de euros. No total, 24 países participaram no projeto.
27 O montante inclui os serviços informáticos para as RER.
28 Relatório de exame técnico final do projeto epSOS, de 12 de novembro de 2014.
29 Em 2014, a Unidade dos Sistemas de Informação da DG SANTE realizou uma avaliação do projeto epSOS para ter uma ideia global das suas realizações e concretizações e resumir as conclusões sobre a maturidade do projeto com vista a uma eventual futura aplicação em larga escala.
30 Sítio Web da Comissão: Cross border digital prescription and patient data exchange are taking off (As receitas eletrónicas e o intercâmbio de dados dos doentes no plano transfronteiriço estão a arrancar).
31 Sítio Internet da Comissão: eHDSI governance (Governação da eHDSI).
32 Annex of the 2016 Annual Activity Report (AAR) — Health and Food Safety (Anexo do Relatório Anual de Atividades relativo a 2016 (RAA) — Saúde e Segurança dos Alimentos). No RAA relativo a 2017, a Comissão indicou nove Estados-Membros, visto que a Dinamarca abandonou os serviços de informação transfronteiriços sobre saúde em linha (ver ponto 10 e caixa 1).
33 República Checa, Estónia, Croácia, Luxemburgo, Malta, Portugal e Finlândia.
34 Comunicação da Comissão «sobre Doenças Raras: desafios para a Europa», COM(2008) 679 final.
35 Recomendação do Conselho, de 8 de junho de 2009, relativa a uma ação europeia em matéria de doenças raras.
36 Comité de Peritos da União Europeia em matéria de Doenças Raras (EUCERD), instituído pela Decisão da Comissão de 30 de novembro de 2009 (2009/872/CE).
37 A Comissão elaborou o quadro para este trabalho nas decisões de execução e delegada de 10 de março de 2014.
38 O RAA da DG SANTE relativo a 2016 (anexo A, p. 169) indica uma meta intercalar de dez RER no âmbito do indicador de resultados 1.5.A: número de RER criadas.
39 Artigo 4.º, n.º 5, da Decisão de execução 2014/287/UE da Comissão.
40 Na amostra de 50 relatórios de avaliação de prestadores de cuidados de saúde relativos a 23 RER, o Tribunal constatou que 30 prestadores de cuidados de saúde não apresentaram informações sobre um plano de ação claro.
41 Artigo 14.º da Decisão de execução 2014/287/UE da Comissão, de 10 de março de 2014.
42 3.º Programa Saúde.
43 Conselho de Estados-Membros das RER, 6 de março de 2018.
44 Com base no acordo administrativo entre a DG SANTE e o JRC.
45 A EUROCAT (Rede Europeia de Vigilância das Anomalias Congénitas) e a SCPE (Vigilância da Paralisia Cerebral na Europa).
46 Em novembro de 2018, a rede de saúde em linha autorizou quatro Estados-Membros a tornarem operacional o intercâmbio transfronteiriço de dados relativos à saúde através da eHDSI: a Finlândia pode enviar receitas eletrónicas, enquanto a Estónia pode recebê-las; a Chéquia e o Luxemburgo podem agora receber historiais eletrónicos dos doentes do estrangeiro, mas nenhum Estado Membro pode ainda enviá-los através da eHDSI; três Estados-Membros (Croácia, Malta e Portugal) tencionam pedir para ficar operacionais no primeiro trimestre de 2019.
47 Cada Estado-Membro participante na eHDSI recebeu o financiamento do programa «Telecomunicações» do MIE para criar o seu ponto de contacto nacional para a saúde em linha e iniciar o intercâmbio transfronteiras de dados de saúde. O calendário da execução à escala nacional faz parte de uma convenção de subvenção que cada Estado-Membro assinou com a Comissão.
48 Os quatro países autorizados a pôr em funcionamento a rede de saúde em linha em novembro de 2018 preveem implementar mais do que um serviço (o envio e a receção de receitas eletrónicas são dois serviços diferentes). i) A Finlândia começou a enviar receitas eletrónicas e prevê começar a recebê-las até ao final de 2019. ii) A Estónia começou a receber receitas eletrónicas e prevê começar a enviá-las até ao final de 2019. iii) A República Checa está pronta a enviar e receber historiais clínicos dos doentes e prevê começar a enviar e receber receitas eletrónicas até ao final de 2020. iv) O Luxemburgo está pronto a receber historiais clínicos dos doentes e prevê começar a enviá-los até ao final de 2019. Prevê igualmente o envio de receitas eletrónicas até ao final de 2020.
Em 11 de março, a Croácia obteve uma recomendação positiva do grupo de peritos dos Estados-Membros em matéria de saúde em linha (eHealth Member State Expert Group — eHMSEG) para iniciar o intercâmbio de receitas eletrónicas (quer para o envio quer para a receção) e de historiais clínicos dos doentes (receção), depois de os auditores terem confirmado que a última medida corretiva pendente foi aplicada com êxito. Esta recomendação tem de ser adotada pela rede de saúde em linha para produzir efeitos.
49 http://eur-lex.europa.eu/legal-content/PT/TXT/HTML/?uri=CELEX:12012E/TXT&from=PT
50 Nomeadamente: 1) as conclusões do projeto-piloto «Rare 2030», financiado pelo Parlamento Europeu, têm por objetivo apoiar futuras decisões políticas, analisar a viabilidade de novas abordagens e propor recomendações políticas (são esperados resultados no início de 2021); 2) a avaliação do terceiro Programa de Saúde (prevista para meados de 2021); 3) a avaliação da Diretiva 2011/24/UE relativa ao exercício dos direitos dos doentes em matéria de cuidados de saúde transfronteiriços (prevista para o final de 2022); 4) a avaliação do Programa-Quadro de Investigação e Inovação Horizonte 2020 (data prevista ainda por confirmar).
51 https://ec.europa.eu/health/sites/health/files/cross_border_care/docs/2018_crossborder_frep_en.pdf
Equipa de auditoria
Os relatórios especiais do Tribunal de Contas Europeu (TCE) apresentam os resultados das suas auditorias relativas às políticas e programas da UE ou a temas relacionados com a gestão de domínios orçamentais específicos. O TCE seleciona e concebe estas tarefas de auditoria de forma a obter o máximo impacto, tendo em consideração os riscos relativos aos resultados ou à conformidade, o nível de receita ou de despesa envolvido, os desenvolvimentos futuros e o interesse político e público.
A presente auditoria de resultados foi realizada pela Câmara de Auditoria I — Utilização sustentável dos recursos naturais, presidida pelo Membro do TCE Nikolaos Milionis. A auditoria foi realizada sob a responsabilidade do Membro do TCE Janusz Wojciechowski, com a colaboração de Kinga Wiśniewska‑Danek, chefe de gabinete, e Katarzyna Radecka‑Moroz, assessora de gabinete; Colm Friel, responsável principal; Joanna Kokot, responsável de tarefa; Nicholas Edwards, responsável de tarefa adjunto; e Frédéric Soblet, Aris Konstantinidis, Anna Zalega, Michela Lanzutti e Jolanta Zemailaite, auditores. Mark Smith prestou assistência linguística.

Da esquerda para a direita: Frédéric Soblet, Kinga Wiśniewska‑Danek, Aris Konstantinidis, Janusz Wojciechowski, Colm Friel, Joanna Kokot, Nicholas Edwards e Jolanta Zemailaite.
Contacto
TRIBUNAL DE CONTAS EUROPEU
12, rue Alcide De Gasperi
1615 Luxembourg
LUXEMBOURG
Tel. +352 4398-1
Informações: eca.europa.eu/pt/Pages/ContactForm.aspx
Sítio Web: eca.europa.eu
Twitter: @EUAuditors
Encontram-se mais informações sobre a União Europeia na rede Internet, via servidor Europa (http://europa.eu)
Luxemburgo: Serviço das Publicações da União Europeia, 2019.
| ISBN 978-92-847-1928-0 | ISSN 1977-5822 | doi:10.2865/547003 | QJ-AB-19-005-PT-N | |
| HTML | ISBN 978-92-847-1921-1 | ISSN 1977-5822 | doi:10.2865/31615 | QJ-AB-19-005-PT-Q |
© União Europeia, 2019
A autorização para utilizar ou reproduzir fotografias ou qualquer outro material em relação ao qual a União Europeia não tenha direitos de autor deve ser diretamente solicitada aos titulares dos direitos de autor.
CONTACTAR A UE
Pessoalmente
Em toda a União Europeia há centenas de centros de informação Europe Direct. Pode encontrar o endereço do centro mais próximo em: https://europa.eu/european-union/contact_pt
Telefone ou correio eletrónico
Europe Direct é um serviço que responde a perguntas sobre a União Europeia. Pode contactar este serviço:
- pelo telefone gratuito: 00 800 6 7 8 9 10 11 (alguns operadores podem cobrar estas chamadas),
- pelo telefone fixo: +32 22999696, ou
- por correio eletrónico, na página: https://europa.eu/european-union/contact_pt
ENCONTRAR INFORMAÇÕES SOBRE A UE
Em linha
Estão disponíveis informações sobre a União Europeia em todas as línguas oficiais no sítio Europa: https://europa.eu/european-union/contact_pt
Publicações da UE
As publicações da UE, quer gratuitas quer pagas, podem ser descarregadas ou encomendadas na EU Bookshop: https://op.europa.eu/pt/publications. Pode obter exemplares múltiplos de publicações gratuitas contactando o serviço Europe Direct ou um centro de informação local (ver https://europa.eu/european-union/contact_pt).
Legislação da UE e documentos conexos
Para ter acesso à informação jurídica da UE, incluindo toda a legislação da UE desde 1951 em todas as versões linguísticas oficiais, visite o sítio EUR-Lex em: http://eur-lex.europa.eu/homepage.html?locale=pt
Dados abertos da UE
O Portal de Dados Abertos da União Europeia (http://data.europa.eu/euodp) disponibiliza o acesso a conjuntos de dados da UE. Os dados podem ser utilizados e reutilizados gratuitamente para fins comerciais e não comerciais.
 Relatório Especial
Relatório Especial