
Actions de l'UE dans le domaine des soins de santé transfrontaliers: de grandes ambitions, mais une meilleure gestion s'impose
(présenté en vertu de l'article 287, paragraphe 4, deuxième alinéa, du TFUE)
À propos du rapport La directive de 2011 sur les soins de santé transfrontaliers vise à garantir le droit des patients de l'UE d'accéder à des soins de santé sûrs et de qualité élevée au sein de l'Union, y compris par-delà les frontières nationales. Ces droits sont également destinés à favoriser une coopération plus étroite entre les États membres dans les domaines de la santé en ligne et de la prise en charge des maladies rares. Nous concluons que, même si les actions de l'UE en matière de soins de santé transfrontaliers renforcent la coopération entre États membres, les patients n'en tirent que des bénéfices limités. Nous avons observé que les citoyens européens sont mieux informés des soins de santé transfrontaliers, mais que pour certains, l'accès à ces informations reste difficile. Nous avons mis en évidence des faiblesses dans la planification stratégique et la gestion des projets par la Commission. Nos recommandations s'articulent autour de plusieurs axes: le soutien de la Commission aux points de contact nationaux, le déploiement des échanges transfrontaliers de données de santé et l'action de l'UE dans le domaine des maladies rares.
Synthèse
ISi les soins de santé transfrontaliers restent bien moins fréquents que les soins de santé délivrés aux citoyens dans leur pays d'affiliation, il arrive que les soins les plus accessibles ou les plus appropriés soient disponibles dans un autre État membre. Permettre aux patients de faire le choix, librement et en connaissance de cause, d'accéder à des soins de santé transfrontaliers peut améliorer leur prise en charge.
IILa directive de 2011 sur les soins de santé transfrontaliers vise à garantir le droit des patients de l'UE d'accéder à des soins de santé sûrs et de qualité élevée dans un autre pays de l'Union, ainsi que leur droit au remboursement de ces soins. La directive favorise une coopération plus étroite dans un certain nombre de domaines, notamment en ce qui concerne l'échange transfrontalier de données relatives aux patients et l'accès aux soins pour les patients atteints de maladies rares.
IIIChaque année, environ 200 000 patients, soit moins de 0,05 % des citoyens de l'UE, utilisent les systèmes mis en place au titre de la directive pour bénéficier d'un traitement médical à l'étranger. Ces dernières années, la France a enregistré le nombre le plus élevé de patients sortants et l'Espagne le plus grand nombre de patients entrants. Lorsqu'ils se sont rendus à l'étranger pour y recevoir un traitement, la plupart des patients ont privilégié les États membres voisins.
IVNous avons examiné si la Commission surveillait convenablement la mise en œuvre de la directive dans les États membres et fournissait des orientations aux points de contact nationaux chargés d'informer les patients sur leurs droits en matière de soins de santé transfrontaliers. Nous avons cherché à déterminer si les résultats obtenus sur le plan des échanges transfrontaliers de données relatives aux patients étaient à la hauteur des attentes et si ces échanges étaient utiles pour les patients. Nous nous sommes également penchés sur les principales actions menées récemment par l'UE dans le domaine des maladies rares et, plus particulièrement, sur la création des réseaux européens de référence. Ces réseaux visent à partager les connaissances et à fournir des conseils en matière de diagnostic et de traitement grâce à des consultations virtuelles entre prestataires de soins de santé à travers l'Europe et, ainsi, à proposer des soins de meilleure qualité.
VNous sommes parvenus à la conclusion que si les actions menées par l'UE en ce qui concerne les soins de santé transfrontaliers ont renforcé la coopération entre les États membres, l'impact sur les patients était limité au moment de notre audit. Ces actions, ambitieuses, doivent être mieux gérées.
VILa Commission surveille convenablement la mise en œuvre de la directive sur les soins de santé transfrontaliers. Elle a indiqué aux points de contact nationaux comment améliorer les informations sur les soins de santé transfrontaliers, mais elle doit poursuivre ses efforts.
VIIAu moment de notre audit, aucun échange de données relatives aux patients n'avait eu lieu entre les États membres, et les avantages de tels échanges pour les patients transfrontaliers n'ont donc pas pu être démontrés. La Commission n'a pas établi de plan de mise en œuvre assorti d'échéances pour sa nouvelle stratégie en matière de santé en ligne, et n'a pas estimé le nombre d'utilisateurs potentiels avant de déployer les échanges transfrontaliers de données de santé.
VIIILe concept de réseaux européens de référence pour les maladies rares remporte largement l'adhésion des parties prenantes de l'UE (organisations de patients, médecins et prestataires de soins). Toutefois, la Commission n'a pas indiqué clairement comment assurer leur financement futur, ni comment les développer et les intégrer dans les systèmes de soins de santé nationaux.
IXSur la base de nos conclusions, nous formulons des recommandations axées sur le soutien de la Commission aux points de contact nationaux, sur le déploiement des échanges transfrontaliers de données de santé et sur l'action de l'UE dans le domaine des maladies rares.
Introduction
01La directive sur les soins de santé transfrontaliers (ci-après «la directive»)1:
- établit le droit des patients de l'UE d'accéder à des soins de santé sûrs et de qualité élevée dans un autre pays de l'Union ainsi que leur droit au remboursement de ces soins;
- prévoit la mise en place de points de contact nationaux (PCN) chargés d'informer les citoyens de leurs droits à bénéficier de soins de santé transfrontaliers;
- vise à favoriser une coopération plus étroite en matière de santé en ligne, notamment pour les échanges transfrontaliers de données relatives aux patients;
- vise à faciliter l'accès aux soins pour les patients atteints de maladies rares, notamment grâce à la création de réseaux européens de référence.
Droits des patients en matière de soins de santé transfrontaliers
02Les soins de santé relèvent de la compétence des États membres et ce sont eux qui financent, gèrent et organisent leurs systèmes de santé2. La directive définit les conditions dans lesquelles un patient peut se rendre dans un autre pays de l'UE pour y recevoir des soins médicaux programmés et être remboursé comme s'il avait reçu ces soins dans son pays d'affiliation. Elle couvre les coûts des soins, ainsi que la prescription et la délivrance de médicaments et de dispositifs médicaux, et vient compléter le cadre juridique déjà établi par le règlement de l'UE sur la coordination des systèmes de sécurité sociale3 (voir annexe I pour une comparaison entre les droits des patients prévus par la directive et ceux prévus par le règlement). La directive vise à faciliter l'accès à des soins de santé transfrontaliers sûrs et de qualité élevée, fondé sur le choix libre et éclairé des patients. En effet, il arrive que les soins les plus accessibles ou les plus appropriés pour les patients ne soient disponibles que dans un État membre autre que celui dans lequel ils sont affiliés. Elle n'encourage toutefois pas les patients à se faire soigner à l'étranger.
03Les patients désireux de se faire soigner dans un autre État membre sont en droit de recevoir les informations pertinentes sur les normes auxquelles sont soumis les traitements et les soins, sur les règles en matière de remboursement et sur le choix de la voie légale la plus avantageuse. Tous les points de contact nationaux devraient fournir ces informations. Les États membres peuvent exiger une autorisation préalable pour certains types de soins, principalement pour les traitements qui impliquent une hospitalisation d'au moins une nuit ou qui nécessitent un recours à des infrastructures ou à des équipements hautement spécialisés. Ils le font dans environ 1 % des cas.
04La directive entérine le principe selon lequel les patients qui se font soigner à l'étranger doivent être remboursés par leur pays d'affiliation, à condition qu'ils aient le droit de bénéficier de ces soins dans ce pays. Un traitement reçu à l'étranger est remboursé à hauteur des coûts qui auraient été pris en charge par le pays d'affiliation. Il est communément admis que la nécessité pour les patients d'avancer les frais, inhérente à la conception de la directive, constitue un obstacle important pour eux4. Néanmoins, la directive laisse la possibilité aux États membres de fournir aux patients une estimation du coût des soins.
05Les demandes de remboursement de soins médicaux reçus à l'étranger au titre de la directive sont nettement moins nombreuses (environ 200 000 demandes par an, qui émanent de moins de 0,05 % des citoyens de l'UE) que celles au titre du règlement sur la coordination des systèmes de sécurité sociale (environ 2 millions de demandes par an pour des traitements non programmés à l'étranger). Les dépenses de soins de santé transfrontaliers encourues au titre la directive sont estimées à 0,004 % du budget annuel consacré aux soins de santé dans l'Union5. Dans une enquête Eurobaromètre de 2015, moins de 20 % des citoyens ont déclaré connaître leurs droits en matière de soins de santé transfrontaliers. La Commission ne dispose pas de données récentes concernant le degré d'information des citoyens au sujet de la directive.
06L'utilisation de la directive varie selon les États membres. Pour les services de soins de santé transfrontaliers qui ne nécessitent aucune autorisation préalable, la France a enregistré le plus grand nombre de patients sortants (près de 150 000 en 2016); l'Espagne, le Portugal et la Belgique traitent quant à eux les plus grands nombres de patients entrants6. Le tableau 1 illustre la mobilité des patients en 2016 dans l'ensemble des pays de l'UE et de l'EEE au titre de la directive, aussi bien pour des produits que pour des services de soins de santé. Ces chiffres englobent la mobilité des patients à la fois pour les traitements non soumis à autorisation préalable (209 534 patients au total) et pour ceux qui y sont soumis (3 562 patients au total).
Tableau 1 – Mobilité des patients en 2016 au titre de la directive
| Patients sortants en 2016 | |
|---|---|
| Pays | Nombre de patients |
| FRANCE | 146 054 |
| DANEMARK | 25 343 |
| FINLANDE | 11 427 |
| NORVÈGE | 10 301 |
| POLOGNE | 8 647 |
| SLOVAQUIE | 6 110 |
| SLOVÉNIE | 1 835 |
| ROYAUME-UNI | 1 113 |
| IRLANDE | 791 |
| TCHÉQUIE | 401 |
| LUXEMBOURG | 277 |
| ITALIE | 201 |
| CROATIE | 200 |
| ROUMANIE | 130 |
| ESTONIE | 80 |
| ISLANDE | 53 |
| BELGIQUE | 30 |
| LETTONIE | 27 |
| LITUANIE | 19 |
| CHYPRE | 13 |
| ESPAGNE | 11 |
| GRÈCE | 10 |
| AUTRICHE | 9 |
| BULGARIE | 5 |
| PORTUGAL | 5 |
| MALTE | 4 |
| ALLEMAGNE | Aucune donnée |
| HONGRIE | Aucune donnée |
| PAYS-BAS | Aucune donnée |
| SUÈDE | Aucune donnée |
| Total | 213 096 |
| Patients entrants en 2016 | |
|---|---|
| Pays | Nombre de patients |
| ESPAGNE | 46 138 |
| PORTUGAL | 32 895 |
| BELGIQUE | 27 457 |
| ALLEMAGNE | 27 034 |
| LUXEMBOURG | 12 530 |
| TCHÉQUIE | 12 300 |
| ESTONIE | 10 044 |
| ITALIE | 9 335 |
| POLOGNE | 6 545 |
| SUÈDE | 6 162 |
| GRÈCE | 5 639 |
| HONGRIE | 4 169 |
| AUTRICHE | 2 437 |
| CROATIE | 1 680 |
| PAYS-BAS | 1 653 |
| ROYAUME-UNI | 1 646 |
| ROUMANIE | 1 003 |
| BULGARIE | 686 |
| IRLANDE | 674 |
| MALTE | 463 |
| FINLANDE | 403 |
| FRANCE | 371 |
| LITUANIE | 369 |
| NORVÈGE | 327 |
| SLOVAQUIE | 259 |
| CHYPRE | 254 |
| DANEMARK | 198 |
| LETTONIE | 167 |
| ISLANDE | 141 |
| SLOVÉNIE | 117 |
| Total | 213 096 |
Source: Cour des comptes européenne, sur la base du rapport sur les données des États membres sur les soins de santé transfrontaliers de patients suivant la directive 2011/24/UE – Année 2016 disponible sur le site web de la Commission.
07La Commission soutient la coopération transfrontalière dans le domaine des soins de santé au moyen de nombreuses études et initiatives – y compris par l'intermédiaire d'Interreg7 – financées par les Fonds structurels et d'investissement européens. Les États membres sont responsables de la gestion de leurs systèmes de santé ainsi que d'éventuels dispositifs de coopération entre eux, souvent mis en place sans la participation de la Commission. La récente étude de cette dernière sur les activités et les investissements de l'UE dans la coopération transfrontalière en matière de soins de santé a permis de mettre en évidence 423 projets financés par l'UE8 soutenant des initiatives dans ce domaine au cours de la période 2007‑2017.
Échanges transfrontaliers de données de santé
08En vertu de la directive, la Commission est tenue d'encourager la coopération entre les États membres dans le domaine de la santé en ligne et de mettre en place un réseau reliant des autorités d'États membres volontaires (réseau «santé en ligne») afin de contribuer à établir des normes communes pour le transfert de données dans le contexte des soins de santé transfrontaliers. La santé en ligne constitue également un élément clé de la stratégie de la Commission pour un marché unique numérique, et son développement au sein de l'UE s'articule autour des actions figurant dans les plans d'action pour la santé en ligne qu'elle a élaborés et dans la stratégie de 2018 en matière de santé en ligne9. Celle-ci a également créé, en 2017, une task force chargée d'examiner les mesures d'incitation à instaurer et les obstacles à lever pour parvenir à un échange sécurisé des données de santé dans l'ensemble de l'UE.
09La Commission, avec l'appui des États membres, met actuellement en place, sur une base volontaire et à l'échelle de l'UE, une infrastructure de services numériques dans le domaine de la santé en ligne (eHDSI), afin de permettre l'échange de données sur la santé des patients – en particulier les ordonnances électroniques et les dossiers des patients – par-delà les frontières nationales. Ce projet associe 22 États membres10 et vise à relier leurs systèmes de santé en ligne à l'eHDSI par l'intermédiaire d'un «portail» spécifique nommé «point de contact national en matière de santé en ligne» (NCPeH) (voir la figure 1, où est décrite la procédure d'échange transfrontalier d'ordonnances électroniques).
Figure 1
Échange transfrontalier d'une ordonnance électronique

Source: Cour des comptes européenne.
L'utilisation d'ordonnances électroniques est monnaie courante dans certains États membres11. D'autres, en revanche, n'ont que récemment commencé à expérimenter ou à mettre en place la dématérialisation des ordonnances. Le peu de services de santé en ligne disponibles à l'échelon national est l'un des principaux obstacles au déploiement de l'eHDSI. En outre, plusieurs États membres ne participent qu'à certains des services de l'eHDSI, voire à aucun (par exemple le Danemark – voir encadré 1 sur les applications de santé en ligne pour les patients).
Encadré 1
Applications de santé en ligne pour les patients au Danemark
Le portail de santé en ligne danois – Sundhed.dk (https://www.sundhed.dk) – permet aux patients d'accéder à leur historique de prescription, de visualiser les consultations programmées avec des prestataires de soins et de demander eux-mêmes le renouvellement de certains médicaments. En 2018, les autorités danoises ont travaillé sur un projet pilote visant à ajouter des fonctionnalités supplémentaires au portail de santé en ligne, afin que les patients qui consultent leur médecin fréquemment (par exemple ceux atteints d'une maladie chronique) puissent planifier plus facilement leurs rendez-vous.
En outre, l'application mobile «Medicinkortet» permet aux patients de demander la prolongation de leurs ordonnances numériques. Toutes les ordonnances médicales établies au Danemark sont dématérialisées.
L'UE finance l'eHDSI au moyen du mécanisme pour l'interconnexion en Europe sur la base d'un projet pilote d'échanges transfrontaliers de données de santé12. Les États membres qui souhaitent commencer les échanges transfrontaliers de données de santé doivent se soumettre à un processus d'essai et d'audit au terme duquel un groupe d'experts des États membres (eHMSEG) formule une recommandation. Il appartient ensuite au réseau «santé en ligne» de se prononcer sur les pays autorisés à rendre opérationnels les échanges transfrontaliers de données de santé.
Initiatives transfrontalières pour les patients atteints de maladies rares
12La directive définit une maladie rare comme une maladie touchant moins de cinq personnes sur 10 000. On estime que 6 000 à 8 000 maladies rares touchent entre 6 % et 8 % de la population de l'UE, soit entre 27 et 36 millions de personnes. Les spécificités des maladies rares – un nombre restreint de patients et des connaissances et une expertise limitées en la matière – ont amené le Conseil de l'Union européenne à y voir «un domaine unique dans lequel une action au niveau communautaire se révèle extrêmement efficace»13.
13Dans sa communication de 2008 intitulée «Les maladies rares: un défi pour l'Europe», la Commission a présenté un cadre stratégique spécifique pour lutter contre les maladies rares, notamment par la mise en place des réseaux européens de référence. La directive confie à la Commission le soin de soutenir les États membres dans la création de ces réseaux. La figure 2 montre les évolutions successives des politiques qui ont conduit à leur mise en place.
Figure 2
Évolutions successives des politiques qui ont conduit à la mise en place des réseaux européens de référence
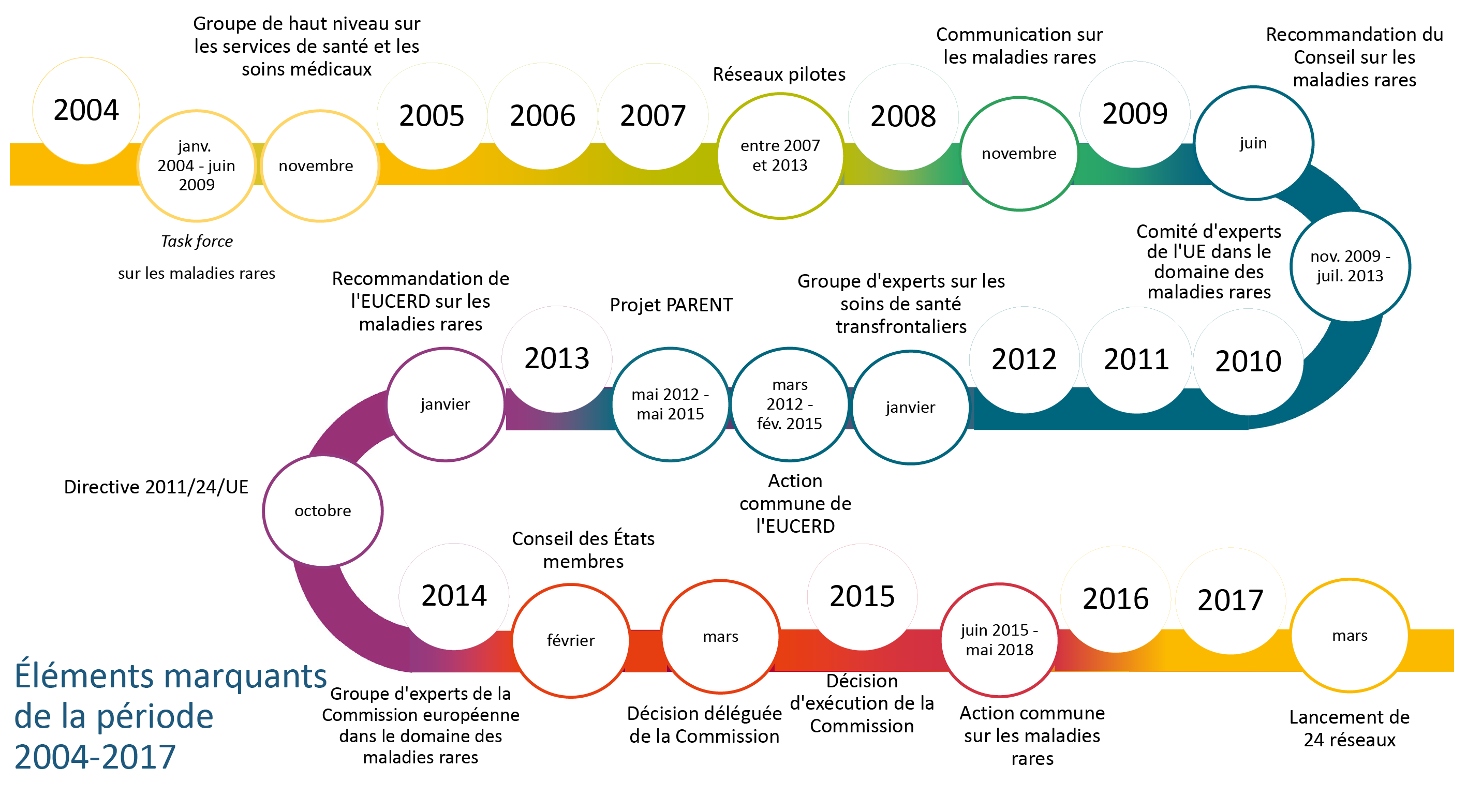
Source: Cour des comptes européenne.
Les réseaux européens de référence (ERN, European Reference Networks) doivent permettre d'accélérer le diagnostic et d'améliorer l'accès à des soins appropriés pour les patients atteints de maladies rares, ainsi que servir de plateformes pour l'élaboration de lignes directrices, pour la formation et pour le partage de connaissances. En 2017, 24 réseaux ont été lancés pour différents types de maladies rares. Chacun de ces réseaux reçoit un financement de 1 million d'euros sur cinq ans provenant du programme Santé de l'UE. La Commission finance également les registres de patients et des activités de soutien pour les ERN, ainsi que le développement d'outils informatiques, notamment au moyen du mécanisme pour l'interconnexion en Europe (MIE).
15Lorsque le dossier d'un patient est transmis à un ERN, un groupe «virtuel» d'experts médicaux est réuni par l'intermédiaire du système de gestion clinique des patients, une application web fournie par la Commission en novembre 2017. Cette application permet aux médecins de partager des informations, des données et des images concernant des patients, sous réserve d'avoir obtenu leur consentement, et de bénéficier d'une aide pour poser le diagnostic et mettre en place le traitement. Parmi les membres des ERN, 73 % s'étaient inscrits afin d'utiliser l'application et 333 groupes avaient été constitués en décembre 2018 (voir l'encadré 2, qui présente des exemples de patients atteints de maladies rares dont le dossier a été consulté par un ERN).
Encadré 2
Exemples de patients atteints de maladies rares dont le dossier a été consulté par un réseau européen de référence
En 2018, les dossiers de deux enfants lituaniens atteints de formes rares de cancers pédiatriques ont été transmis au Réseau européen de référence pour les cancers de l'enfant. Des spécialistes ont émis un avis par l'intermédiaire de l'ERN et de nouveaux traitements ont été administrés à ces enfants.
En 2017, le dossier d'un enfant finlandais âgé de quatre ans présentant une anomalie cérébrale spécifique à l'origine d'une épilepsie sévère a été transmis au Réseau européen de référence pour les épilepsies. Son médecin en Finlande a consulté les spécialistes du réseau afin d'obtenir des conseils sur le choix du traitement le plus adapté. Des spécialistes d'au moins six autres pays ont participé aux discussions et au partage de connaissances sur la prise en charge du garçonnet.
Dans ces deux exemples, les ERN ont permis d'obtenir de précieux conseils pour la prise en charge des patients.
Le conseil des États membres en charge des ERN14 se prononce sur la création des réseaux proposés et sur l'admission de leurs membres. Fin 2018, 952 prestataires de soins de santé (des instituts et des services hospitaliers) dans plus de 300 hôpitaux répartis à travers l'UE participaient aux ERN. Aucun réseau ne couvrait plus de 19 États membres. La figure 3 montre que la répartition des prestataires de soins de santé membres d'ERN varie au sein de l'Union. Le plus grand nombre d'entre eux viennent d'Italie. Cet État membre a instauré de longue date une stratégie nationale structurant ses actions dans le domaine des maladies rares, ainsi qu'un réseau national de centres et d'hôpitaux spécialisés qualifiés pour aider les patients atteints de maladies rares.
Figure 3
Répartition des prestataires de soins de santé membres de réseaux européens de référence au sein de l'Union

Source: Cour des comptes européenne, sur la base des données sur les prestataires de soins de santé membres de réseaux européens de référence, par État membre, fournies par la Commission, situation en février 2019.
Étendue et approche de l'audit
17L'un des objectifs stratégiques de la Cour des comptes européenne est d'examiner la performance de l'action de l'UE dans les domaines où elle est la plus importante pour les citoyens15. L'amélioration des infrastructures et des services de santé européens, de leur accessibilité et de leur efficacité est un domaine dans lequel l'action de l'UE peut apporter une valeur ajoutée à ses citoyens. Notre audit a commencé dix ans après l'approbation, par la Commission, de sa stratégie sur les maladies rares et le lancement du principal projet pilote de l'UE sur les échanges transfrontaliers de données de santé. Il a visé à répondre à la question suivante:
Les actions de l'UE en matière de soins de santé transfrontaliers profitent-elles aux patients?
18Nous avons examiné si:
- la Commission surveillait convenablement la mise en œuvre de la directive de l'UE sur les soins de santé transfrontaliers dans les États membres;
- les résultats obtenus à ce jour en ce qui concerne les échanges transfrontaliers de données de santé étaient à la hauteur des attentes;
- les actions de l'UE dans le domaine des maladies rares apportaient une valeur ajoutée aux efforts déployés par les États membres pour faciliter l'accès des patients aux soins de santé transfrontaliers.
Notre audit a porté sur la période qui a suivi l'adoption de la stratégie de la Commission sur les maladies rares et le lancement du principal projet pilote de l'UE sur les échanges transfrontaliers de données de santé, en 2008. Nous avons réalisé nos travaux d'audit entre février et novembre 2018 et nous nous sommes entretenus avec des représentants de la direction générale de la santé et de la sécurité alimentaire (DG SANTÉ), de la direction générale des réseaux de communication, du contenu et des technologies (DG CONNECT) et du Centre commun de recherche (JRC) de la Commission, ainsi qu'avec les autorités de cinq États membres16 responsables de la mise en œuvre de la directive. Nous avons sélectionné les États membres sur la base des principaux projets financés par l'UE dans le domaine des échanges transfrontaliers de données de santé.
20Nous avons également réalisé une enquête auprès de tous les représentants des États membres au sein du groupe d'experts sur les soins de santé transfrontaliers, afin de recueillir leur avis sur les principales évolutions de l'accès des patients aux soins de santé transfrontaliers et les obstacles majeurs qui les entravent, ainsi qu'auprès des représentants du réseau «santé en ligne», afin de connaître leur opinion sur les travaux de la Commission dans le domaine des échanges transfrontaliers de données relatives aux patients. Nous avons reçu 15 réponses du groupe d'experts sur les soins de santé transfrontaliers et dix du réseau «santé en ligne».
21Nous avons contrôlé des projets financés par l'UE qui visaient à faciliter l'accès aux soins de santé transfrontaliers, notamment des projets portant sur l'échange transfrontalier de données de santé et sur le développement et la maintenance de la plateforme européenne pour les registres de maladies rares. Nous avons constitué un groupe d'experts en vue obtenir un éclairage indépendant sur la politique de l'UE dans le domaine des maladies rares et sur les réseaux européens de référence.
Observations
La Commission a veillé à ce que la directive de l'UE sur les soins de santé transfrontaliers soit appliquée
22Pour surveiller la mise en œuvre de la directive, la Commission doit faire en sorte qu'elle soit effectivement transposée par les États membres et s'en assurer au moyen de contrôles de conformité et d'exhaustivité. La Commission est également tenue de rendre compte de l'application de la directive et de guider correctement les points de contact nationaux chargés d'informer les patients sur les soins de santé transfrontaliers.
La Commission a surveillé et fait respecter la transposition de la directive
23Passé le 25 octobre 2013, date limite de transposition de la directive, et à l'issue de ses contrôles concernant l'exhaustivité de la transposition par les États membres, la Commission a ouvert 26 procédures d'infraction pour notification tardive ou incomplète des mesures de transposition. En outre, elle a ouvert 21 procédures d'infraction pour transposition tardive ou incomplète de la directive d'exécution relative à la reconnaissance des prescriptions médicales établies dans un autre État membre17. La Commission a achevé de clôturer ces procédures en novembre 2017, après que tous les États membres ont communiqué des notifications complètes des mesures de transposition.
24La Commission vérifie la législation des États membres pour établir s'ils ont correctement transposé les dispositions de la directive. Afin de cibler ces contrôles, la Commission a recensé quatre domaines prioritaires susceptibles de constituer des obstacles pour les patients transfrontaliers, à savoir: les systèmes de remboursement, le recours à l'autorisation préalable, les contraintes administratives et la facturation des patients entrants. À la suite de ces contrôles, la Commission a ouvert d'office 11 procédures d'infractions, dont quatre avaient été clôturées en novembre 2018, après modification des mesures de transposition en droit national par les États membres.
25Nous estimons que les contrôles de la Commission ont permis d'améliorer les systèmes et les pratiques des États membres.
La Commission a fait rapport sur l'application de la directive en temps utile
26La Commission est tenue d'établir un rapport sur l'application de la directive tous les trois ans, à partir de 201518. Ce rapport doit contenir des informations sur les flux de patients et les coûts associés à leur mobilité. La directive n'oblige pas les États membres à recueillir des données sur les flux de patients, mais elle précise qu'ils doivent apporter à la Commission l'assistance et toutes les informations disponibles pour élaborer le rapport. En 2013, les États membres ont convenu de fournir chaque année certaines données à la Commission.
27La plupart des États membres ont adopté tardivement les mesures de transposition en droit national (voir point 23), ce qui a retardé la transmission des données à la Commission en 2015. En 2017, 26 États membres ont fourni les données en question, mais elles étaient incomplètes pour six d'entre eux. En outre, les données n'étaient pas comparables d'un pays à l'autre, car certains États membres ont déclaré tous les remboursements sans préciser s'ils avaient été accordés au titre de la directive ou du règlement sur la coordination des systèmes de sécurité sociale. La Commission a reconnu que la précision des données contenues dans les rapports n'était pas optimale. Par exemple, la vue d'ensemble des flux de patients était incomplète. Le tableau 1 indique que quatre États membres n'ont pas fourni de données sur les flux de patients sortants en 2016.
28Malgré ces difficultés, la Commission s'est acquittée de son obligation de faire rapport dans les délais. Elle a adopté son dernier rapport au mois de septembre 2018 et a présenté une vue d'ensemble des flux de patients et de l'impact financier des soins de santé transfrontaliers au titre de la directive.
La Commission a indiqué aux points de contact nationaux comment améliorer l'information sur les soins de santé transfrontaliers
29La Commission assiste les points de contact nationaux et leur indique comment fournir des informations claires et complètes sur les droits des patients en matière de soins de santé transfrontaliers. Pour ce faire, elle a publié plusieurs études consacrées au sujet19. En 2013, soit avant l'expiration du délai de transposition de la directive, la Commission a transmis aux États membres une note d'orientation sur les parcours de soins transfrontaliers à la disposition des patients, l'un au titre de la directive sur les soins de santé transfrontaliers, et l'autre au titre du règlement sur la coordination des systèmes de sécurité sociale.
30Toutefois, moins de la moitié des sites web des points de contact nationaux expliquaient les deux manières différentes pour les patients d'accéder à des soins de santé dans d'autres pays20. En mars 2018, dans le but de lever toute confusion entre les deux textes, la Commission a organisé un atelier consacré au renforcement des capacités des PCN et élaboré une boîte à outils destinée à les aider concrètement à communiquer les informations aux patients. Notre enquête a montré que les autorités compétentes dans les États membres ont apprécié les boîtes à outils, mais qu'elles ont besoin d'un soutien supplémentaire pour être en mesure d'expliquer la différence aux patients.
31Une étude récente de la Commission21 a jugé que les informations mises à la disposition des patients sur les sites web des PCN étaient généralement appropriées et satisfaisaient aux exigences de la directive, mais elle souligne que les sites web pourraient fournir de plus amples informations sur les droits des patients entrants et sur le remboursement des soins de santé transfrontaliers pour les patients sortants. En outre, dans un rapport sur la directive, le Parlement européen a relevé que «les sites web des PCN manquaient généralement d'informations approfondies sur les droits des patients»22.
32La directive n'impose pas aux PCN de présenter sur leurs sites web des informations concernant les réseaux européens de référence. Nous avons constaté que certains PCN ne fournissaient aucune information à ce sujet et que d'autres réfléchissaient à la manière de le faire. Les représentants de l'Allemagne, de l'Irlande, de l'Estonie, de la Lituanie et du Royaume-Uni se sont montrés intéressés par une coopération avec le conseil des États membres en charge des ERN23. Les experts dans le domaine des maladies rares que nous avons consultés estiment que les PCN devraient fournir des informations sur les réseaux.
Échanges transfrontaliers de données sur la santé des patients: les résultats obtenus au moment de l'audit n'étaient pas à la hauteur des grandes ambitions affichées
33La création de mécanismes d'échange de données sur la santé des patients au sein de l'UE exige un cadre clair en matière de stratégie et de gouvernance, qui recueille l'adhésion des États membres. Des objectifs explicites doivent être fixés, et la performance faire l'objet d'un suivi régulier. Avant de lancer des projets de grande envergure, la Commission devrait, avec le soutien des États membres, estimer le nombre d'utilisateurs potentiels. Des enseignements doivent être tirés des projets pilotes antérieurs.
La stratégie de 2018 en matière de santé en ligne ne comportait pas de plan de mise en œuvre
34Les plans d'action pour la santé en ligne de la Commission exposent son approche de la santé en ligne, y compris des échanges transfrontaliers de données sur la santé des patients. Le plan d'action actuel porte sur la période 2012‑2020. En avril 2018, la Commission a adopté une nouvelle stratégie en matière de santé en ligne24, dont la portée dépasse celle du plan d'action actuel et qui intègre notamment l'élargissement éventuel à l'échange transfrontalier de dossiers de santé informatisés.
35En 2014, la Commission a publié une évaluation intermédiaire du plan d'action pour la santé en ligne25. Globalement positive, l'évaluation a tout de même permis de mettre en évidence certaines faiblesses et préconise que la Commission actualise le plan afin d'y inclure les questions les plus importantes, d'établir une structure de gouvernance claire et de créer un mécanisme de suivi et de coordination.
36La Commission a mis en œuvre la plupart des actions prévues dans le plan d'action pour la santé en ligne. Elle n'a pas suivi la recommandation résultant de l'évaluation de 2014 visant à actualiser son plan d'action, pas plus qu'elle n'a révisé celui-ci pour l'adapter à la stratégie de 2018 en matière de santé en ligne. Par conséquent, certaines questions importantes telles que l'entrée en vigueur du règlement général sur la protection des données ne sont pas abordées dans le plan. En outre, la Commission n'a pas défini les responsabilités en ce qui concerne sa mise en œuvre.
37La stratégie de 2018 en matière de santé en ligne fait état de nouvelles difficultés, posées notamment par l'entrée en vigueur du règlement général sur la protection des données et par les menaces qui pèsent sur la cybersécurité. Pourtant, cette stratégie ne comportait pas de plan de mise en œuvre assorti d'échéances pour les résultats et les réalisations attendus, et qui indiquerait l'approche retenue par la Commission pour son exécution. Lorsque cette dernière a lancé sa stratégie de 2018 en matière de santé en ligne, l'unique évaluation de son plan d'action 2012‑2020 remontait à 2014.
La Commission a sous-estimé les difficultés inhérentes au déploiement de l'eHDSI
38Lors de ses travaux sur les échanges de données sur la santé des patients entre les États membres, la Commission a procédé en deux étapes: un projet pilote (epSOS)26 de 2008 à 2012, dont la facture s'est élevée à 18 millions d'euros, et un projet de déploiement actuellement en cours (eHDSI), dont le budget atteint 35 millions d'euros27 et qui a été lancé en 2015.
39Le projet epSOS avait pour objectif d'établir un cadre et une infrastructure pour les technologies de l'information et de la communication visant à permettre un accès transfrontalier sécurisé aux données sur la santé des patients. L'expérience consistait à tester la faisabilité fonctionnelle, technique et juridique, ainsi qu'à jauger l'intérêt suscité par la solution proposée pour les échanges transfrontaliers de données de santé. Le but était de démontrer la mise en œuvre pratique de la solution dans un certain nombre de configurations et d'États participants.
40Le projet a permis de mettre au point les définitions des contenus des données des dossiers de patients et des ordonnances électroniques (voir point 09), ainsi que des mécanismes permettant de tester, d'examiner et d'approuver les échanges transfrontaliers de données de santé. Il a contribué à l'élaboration des spécifications et des lignes directrices relatives à l'interopérabilité des systèmes de santé en ligne. Il a également fourni des normes communes afin de favoriser ces échanges et a donné la preuve concrète de l'engagement des États membres à coopérer dans ce domaine.
41Lors de la phase de planification du projet, la portée et l'ampleur des vérifications nécessaires avant la mise en œuvre effective n'ont pas été définies. Les tests concernant la faisabilité de la solution proposée ont porté sur 43 transferts de données de patients. Par conséquent, la démonstration pratique de la solution proposée fournie par le projet est restée limitée. Lors de l'examen final du projet, des évaluateurs externes ont conclu que le nombre de dossiers de patients et d'ordonnances électroniques réels était trop faible pour pouvoir considérer les services epSOS comme opérationnels et solides28. La Commission a toutefois considéré que cet échange, malgré sa portée limitée, était suffisant pour démontrer la faisabilité de l'eHDSI.
42La Commission a évalué le projet epSOS en 2014. Elle a relevé que bien que le nombre d'échanges de données de patients, inférieur aux prévisions, n'ait pas été suffisant à ce jour dans le cadre du projet epSOS pour être jugé pertinent sur le plan statistique, la validité de l'approche de l'interopérabilité transfrontalière de ce projet n'en a pas moins été démontrée29. En outre, les problèmes d'interopérabilité aux niveaux juridique, organisationnel et sémantique avaient été plus importants que prévu. La Commission a par ailleurs décelé des coûts non éligibles déclarés par les contractants du projet, principalement en lien avec des frais de personnel. Au moment de notre audit, elle procédait au recouvrement des dépenses non éligibles, pour un montant équivalant à 42 % du financement fourni.
43Malgré ces difficultés, la Commission a décidé en 2015 d'utiliser les réalisations de ce projet pilote comme base pour le développement à grande échelle de l'eHDSI. L'architecture, les spécifications techniques et sémantiques, ainsi que les accords d'ordre juridique, organisationnel et politique entre les États membres participants reposent sur les éléments livrables du projet epSOS.
44Nous avons mis en évidence des faiblesses dans la manière dont la Commission a élaboré ce projet complexe, notamment le fait qu'elle n'ait pas estimé le nombre d'utilisateurs potentiels (patients et prestataires de soins, à savoir les pharmacies et les hôpitaux) des services numériques de santé en ligne transfrontaliers fournis par l'eHDSI et qu'elle n'ait pas évalué le rapport coût-efficacité de ces services avant le lancement de l'infrastructure. Nous en concluons que la Commission a sous-estimé les difficultés inhérentes au déploiement, à l'échelle de l'UE, d'une telle infrastructure dans le domaine de la santé en ligne.
La Commission a surestimé le succès probable de l'eHDSI
45Les annonces de la Commission concernant le volume probable des échanges transfrontaliers de données de santé ont été trop optimistes (voir encadré 3).
Encadré 3
Annonces de la Commission concernant le succès de l'eHDSI
En décembre 2017, la Commission a annoncé qu'en 2018, 12 États membres de l'UE commenceraient à échanger régulièrement des données relatives aux patients30.
Sur son site web consacré à la gouvernance de l'eHDSI, la Commission indique prévoir qu'aux alentours de 2019, l'échange transfrontalier de données de santé au sein de l'UE commencera à devenir une pratique acceptée des systèmes de soins de santé nationaux31.
Lorsqu'elle a évalué sa propre performance en 2017, la Commission a établi que dix États membres avaient la capacité d'échanger des données de santé et d'adhérer aux services d'information transfrontaliers dans le domaine de la santé en ligne32. Ce chiffre provient des réponses fournies par les États membres à une question sur la mise en place de leurs portails nationaux dans le domaine de la santé en ligne et inclut les États membres qui venaient à peine de commencer à créer leurs portails, mais n'avaient pas confirmé être prêts à effectuer des échanges transfrontaliers de données de santé.
Au moment de notre audit (novembre 2018), les échanges transfrontaliers de données sur la santé des patients via l'eHDSI n'avaient pas encore commencé (voir l'annexe II, qui montre les dates prévues pour le déploiement effectif des échanges transfrontaliers de données de santé entre les États membres). À ce moment-là, la Commission avait évalué la capacité de sept États membres33 à mettre en service les échanges transfrontaliers. Quatre d'entre eux (la Tchéquie, l'Estonie, le Luxembourg et la Finlande) avaient fait l'objet de contrôles de suivi. En octobre 2018, le groupe eHMSEG a recommandé une mise en service par ces États membres, à condition que toutes les mesures correctrices aient été prises. La figure 4 présente le processus au terme duquel les États membres adhèrent à l'eHDSI, ainsi que la situation en 2018.
Figure 4
Le processus d'adhésion à l'eHDSI – situation en 2018

Source: Cour des comptes européenne, sur la base des informations fournies par la Commission.
Nous avons également constaté que l'adhésion de ces quatre États membres à l'eHDSI englobait différents types de services de santé en ligne. Au moment de l'audit, la Finlande était prête pour l'envoi d'ordonnances électroniques, tandis que l'Estonie pouvait en recevoir (au début de l'année 2019, c'était le seul échange d'ordonnances électroniques disponible en Europe). D'après la Commission, 550 ordonnances électroniques ont été traitées par ce moyen entre janvier et fin février 2019. La Tchéquie et le Luxembourg étaient prêts à recevoir de l'étranger des dossiers de patients informatisés, mais aucun État membre ne pouvait encore en envoyer via l'eHDSI. En outre, au début, seuls certains prestataires de soins de santé et certaines pharmacies implantés dans ces pays utiliseront le système. L'encadré 4 explique les bénéfices que pourraient tirer les patients des échanges transfrontaliers d'ordonnances électroniques et de dossiers de patients informatisés.
Encadré 4
Échanges transfrontaliers
Ordonnances électroniques (cas de la Finlande et de l'Estonie)
Lorsqu'un patient en possession d'une ordonnance électronique délivrée en Finlande se rend dans une pharmacie estonienne pour retirer ses médicaments, la pharmacie doit enregistrer l'identifiant du patient. Elle doit ensuite transmettre les données de prescription, pour autant que le patient ait donné son consentement, au portail estonien de santé en ligne (NCPeH) qui le transmettra à son tour au portail finlandais. Une fois le médicament délivré au patient par la pharmacie estonienne, le portail finlandais de santé en ligne doit être informé que l'ordonnance électronique a été traitée (voir figure 1).
Dossiers de patients informatisés
Si une personne est en situation d'urgence médicale ou effectue une visite non programmée chez un prestataire de soins de santé à l'étranger, le personnel médical pourra accéder, par voie électronique, à des informations médicales de base concernant le patient par l'intermédiaire du portail de santé en ligne du pays d'affiliation de ce dernier. Le dossier du patient peut comporter des informations sur d'éventuelles allergies médicamenteuses et faciliter le diagnostic à l'étranger.
Les réseaux européens de référence pour les maladies rares constituent une innovation ambitieuse, mais leur viabilité n'a pas été démontrée
48Pour fournir un soutien efficace aux États membres dans la création des réseaux européens de référence, la Commission doit inscrire son aide dans un cadre juridique ainsi que dans une stratégie cohérente et suivre une feuille de route claire.
La Commission n'a pas actualisé le cadre entourant les actions de l'UE dans le domaine des maladies rares
49La création des réseaux européens de référence s'inscrit dans une politique plus vaste de l'UE dans le domaine des maladies rares, qui comporte différents volets, tels que le soutien à l'élaboration de plans nationaux sur les maladies rares, l'amélioration de la normalisation de la nomenclature des maladies rares et le soutien à la recherche sur les maladies rares. La communication de 2008 de la Commission sur les maladies rares avait pour ambition «d'encourager la coopération entre les États membres et, si nécessaire, d'appuyer leur action». L'objectif était de définir «une stratégie communautaire globale pour aider les États membres»34 à lutter contre les maladies rares. Le Conseil a approuvé cette approche dans sa recommandation du 8 juin 2009 relative à une action dans le domaine des maladies rares35.
50La Commission a publié en 2014 un rapport d'exécution sur sa communication et sur la recommandation du Conseil. Elle y conclut que «dans l'ensemble, les objectifs de la communication et de la recommandation du Conseil ont été atteints». Ces objectifs consistaient notamment à définir clairement les maladies rares et à améliorer leur codification dans les systèmes de santé. Le rapport avertit cependant qu'«il reste du chemin à parcourir» avant que les patients atteints d'une maladie rare aient accès aux soins dont ils ont besoin, où qu'ils vivent dans l'Union. Il pointe également l'absence de stratégies dans le domaine des maladies rares dans certains États membres, un aspect qui appelle des efforts supplémentaires. Il dresse une liste de 11 actions que la Commission envisage de mener, parmi lesquelles figure la poursuite du soutien à la plateforme européenne pour les registres de maladies rares et à l'élaboration de programmes pour les maladies rares.
51Bien que la conclusion établisse que les objectifs ont été atteints, neuf des 11 actions envisagées correspondent à la poursuite d'initiatives existantes. La Commission n'a pas actualisé sa stratégie sur les maladies rares depuis 2008, bien qu'elle encadre des initiatives importantes telles que les réseaux et la plateforme européenne pour les registres de maladies rares.
La Commission n'a pas appliqué tous les enseignements tirés des ERN pilotes
52La Commission a financé dix réseaux pilotes entre 2007 et 2013. Son comité consultatif sur les maladies rares (EUCERD)36 a évalué ces réseaux et a publié en 2011 un rapport intitulé Preliminary analysis of the outcomes and experiences of pilot European Reference Networks for rare diseases. Pourtant, lorsque la Commission a mis en place les ERN, elle n'a remédié qu'à certains des problèmes soulevés dans l'évaluation de 2011, comme le soutien destiné aux registres de patients, la nécessité de disposer d'un outil informatique spécifique et l'impératif, pour chaque membre du réseau, de se doter de processus de contrôle de la qualité de ses soins. Les problèmes suivants restent notamment d'actualité:
- la viabilité des réseaux au-delà de leur période de financement initiale;
- le développement d'un système de surveillance continue et de contrôle de la qualité pour les membres du réseau;
- les difficultés administratives et les coûts financiers liés au développement d'un réseau;
- un soutien durable aux registres de patients.
Depuis sa création en 2014, le conseil des États membres en charge des ERN y travaille et a accompli des progrès en ce qui concerne la surveillance continue et le contrôle de la qualité (pour lesquels il a approuvé, en septembre 2018, un ensemble d'indicateurs de base réunis par les ERN). Toutefois, de nouvelles questions, telles que l'intégration des réseaux dans les systèmes de soins nationaux et la coopération avec l'industrie, sont apparues et n'ont pas encore été résolues. La figure 5 montre les différentes difficultés auxquelles sont confrontés les réseaux pour lesquelles la Commission, le conseil des États membres ou le groupe de coordonnateurs des réseaux recherchent actuellement des solutions.
Figure 5
Difficultés auxquelles se heurte le développement des réseaux européens de référence

Source: Cour des comptes européenne, sur la base des procès-verbaux des réunions du conseil des États membres en charge des réseaux européens de référence.
La Commission a soutenu la mise en place de 24 réseaux européens de référence mais n'a pas mis au point de système efficace pour en évaluer les membres
54La directive confie à la Commission le soin d'arrêter une liste de critères et de conditions spécifiques auxquels doivent satisfaire les prestataires de soins de santé pour devenir membres d'un réseau37. La Commission a eu recours à un consultant pour élaborer un ensemble de lignes directrices pour les candidats, ainsi que pour l'organe d'examen indépendant, chargé d'examiner les ERN et les candidatures présentées par les prestataires de soins de santé individuels. La Commission s'est employée à informer les parties intéressées du lancement des ERN et elle a dépassé son objectif initial de soutenir la mise en place de dix réseaux38, puisque 24 ont été créés (voir l'annexe III, qui présente la liste des réseaux européens de référence).
55La figure 6 montre la procédure d'examen des candidatures présentées par les prestataires de soins de santé qui souhaitent adhérer aux ERN. Avant de présenter sa candidature, chaque prestataire de soins de santé a d'abord dû obtenir le soutien de l'autorité compétente de son État membre. La procédure d'évaluation au niveau de l'UE a uniquement consisté en un contrôle de l'admissibilité des candidatures et en un examen d'un échantillon de 20 % d'entre elles.
Figure 6
Arbre de décision pour le contrôle de l'admissibilité et la procédure d'examen des candidatures présentées par les prestataires de soins de santé qui souhaitent adhérer aux réseaux

Source: Analyse de la Cour des comptes européenne, sur la base de documents fournis par l'Agence exécutive pour les consommateurs, la santé, l'agriculture et l'alimentation.
L'organe d'examen indépendant a délivré 62 rapports préliminaires négatifs. Dans tous ces cas, les candidats ont fourni des informations39 sur les questions en suspens, qui ont permis à l'organe d'examen de rendre un avis favorable. Cependant, notre analyse d'un échantillon40 de rapports d'examen a révélé que, dans de nombreux cas, l'organe d'examen avait rendu un avis définitif favorable sur la base d'informations incomplètes. Au terme de la procédure d'examen, 952 des 953 prestataires de soins de santé ayant présenté leur candidature ont été acceptés au sein des réseaux. Nous en concluons que, dans la pratique, cette procédure a apporté une valeur ajoutée limitée à la mise en place des ERN.
57À l'origine, le système d'examen par échantillonnage n'était pas complété par d'autres mesures de surveillance ou d'évaluation. La Commission travaille avec les représentants des États membres et les coordonnateurs des ERN depuis décembre 2016 sur la mise au point d'un système de surveillance continue par elle-même et d'auto-évaluation périodique pour tous les membres des réseaux. Toutefois, au moment de l'audit, ils n'avaient pas décidé des mesures à prendre dans l'éventualité où ce système de surveillance repérerait des prestataires de soins de santé insuffisamment performants. Par ailleurs, la Commission a l'intention de procéder à une évaluation des réseaux à l'issue de leur période de financement de cinq ans41.
Le budget de l'Union ne comporte pas de ligne budgétaire spécifique pour les réseaux européens de référence
58En vertu de la directive, la Commission est tenue de soutenir les États membres dans la création des ERN. Le budget de l'Union ne comporte pas de ligne budgétaire spécifique pour les coûts liés à ces réseaux. Afin de soutenir leur fonctionnement, la Commission a octroyé des financements en faisant appel à différents programmes (le programme Santé et le mécanisme pour l'interconnexion en Europe) et mécanismes de dépenses (appels à propositions et appels d'offres). Elle n'a pas élaboré de plan de dépenses global pour la période 2017‑2021 à transmettre aux réseaux et à l'autorité budgétaire.
59En novembre 2017, la Commission a équipé les réseaux du système de gestion clinique des patients (CPMS, Clinical Patient Management System) permettant de partager et de consulter des données relatives aux patients (voir point 15). Les consultations effectuées au moyen de ce système constituent un pan important des travaux des ERN. Cependant, le recours à des consultations transfrontalières par l'intermédiaire du système de gestion clinique des patients a mis en évidence la question de la reconnaissance du temps consacré par les médecins au diagnostic et au traitement de patients résidant dans un autre État membre. La figure 7 montre, pour chaque réseau, le nombre de comités de consultation créés dans le système entre novembre 2017 et décembre 2018.
Figure 7
Les comités de consultation, signe de l'activité d'un réseau

Source: Rapport de décembre 2018 du système de gestion clinique des patients de la Commission.
Chaque coordonnateur de réseau reçoit actuellement de l'Union 1 million d'euros de financement42 sur cinq ans pour ses coûts administratifs. Le versement aux réseaux des fonds destinés à couvrir leurs coûts administratifs annuels a souvent connu des retards. Une enquête menée par la Commission auprès des coordonnateurs des ERN en janvier 2018, à laquelle 20 ont répondu, a montré que la viabilité du financement était l'une des deux grandes difficultés auxquelles ils se heurtaient43. Sur les 24 ERN, 17 ont fait figurer la recherche d'autres sources de financement dans leurs objectifs ou leurs stratégies d'atténuation des risques.
61En plus de ce financement des coûts administratifs, la Commission a octroyé des subventions aux réseaux afin de les aider à atteindre leurs objectifs. Elle a lancé des procédures de marchés publics pour concevoir des activités destinées à soutenir la mise en place et le développement des réseaux. Fin 2018, ces procédures concernaient:
- l'utilisation des solutions de santé en ligne, à savoir le système de gestion clinique des patients (5 millions d'euros, provenant du mécanisme pour l'interconnexion en Europe);
- l'élaboration du guide de pratique clinique (au total 4 millions d'euros, provenant du programme Santé);
- les registres des réseaux (au total 2 millions d'euros pour cinq réseaux en 2018, financés par le programme Santé);
- les formations et les outils destinés aux coordonnateurs des réseaux (appel d'offres à des sociétés externes pour une valeur estimée à 400 000 euros);
- la fourniture de prestations de secrétariat au groupe de travail des coordonnateurs des réseaux (appel d'offres à des sociétés externes pour une valeur estimée à 380 000 euros);
- l'élaboration de modèles de documents pour les réseaux (appel d'offres à des sociétés externes pour une valeur estimée à 100 000 euros).
Les coordonnateurs des réseaux estiment que leur participation aux nombreux appels à propositions lancés par la Commission a fait peser sur eux une charge administrative considérable. En outre, la viabilité à long terme des registres des ERN, financés actuellement par le programme Santé, reste incertaine malgré l'accent mis par la Commission, dans sa communication de 2008 sur les maladies rares, sur le risque que ferait courir le choix d'un financement de projets pour les soutenir.
Malgré les retards, la Commission lance actuellement une plateforme européenne pour les registres de maladies rares
63Dans sa communication de 2008 sur les maladies rares, la Commission souligne l'importance des bases de données et des registres pour permettre les recherches épidémiologiques et cliniques sur les maladies rares. Elle y insiste également sur la nécessité de garantir la viabilité à long terme de ces systèmes. En réponse à ce défi, le JRC a commencé en 2013 à développer la plateforme européenne pour les registres de maladies rares, cofinancée par le programme Santé44 et ouverte à tous les registres de maladies rares européens. La plateforme du JRC vise à remédier à la fragmentation des données contenues dans les registres de patients atteints de maladies rares à travers toute l'Europe en encourageant l'adoption de normes à l'échelle de l'UE pour la collecte de données et en fournissant des outils d'interopérabilité pour les échanges de données sur les maladies rares.
64Nous avons constaté que, parallèlement à la plateforme du JRC, la Commission a financé un autre projet, RD-Connect, à l'aide du programme de financement pour la recherche et l'innovation (septième programme-cadre), dont l'un des objectifs était la création d'un répertoire de registres de patients pour la recherche sur les maladies rares. Les deux projets poursuivent un objectif semblable, à savoir réunir les registres existant au sein de l'UE pour permettre aux chercheurs d'accéder plus facilement à des données sur les maladies rares. Par conséquent, la Commission finance actuellement deux projets dont les réalisations sont susceptibles de se chevaucher.
65Au moment de l'audit, il était prévu de mettre en service la plateforme du JRC en février 2019, soit plus de deux ans après la date fixée initialement. L'une des raisons de ce retard a été que le développement de cette plateforme impliquait également le transfert de deux réseaux existants45 vers le JRC, ce qui a nécessité plus de temps et de ressources que prévu. Nous avons constaté que le calendrier initial et l'enveloppe budgétaire prévue pour la plateforme étaient irréalistes. En outre, le financement fourni par la DG SANTE à la plateforme du JRC couvre actuellement environ 45 % des coûts des travaux, mais rien n'est prévu pour assurer la viabilité financière de la plateforme ou son succès, à l'exception d'un plan de diffusion élaboré au cours du quatrième trimestre de 2017.
Conclusions et recommandations
66Nous avons examiné la surveillance, par la Commission, de la transposition de la directive sur les soins de santé transfrontaliers dans les États membres, ainsi que les résultats obtenus jusqu'à présent en ce qui concerne les échanges transfrontaliers de données de santé. Nous nous sommes également penchés sur les actions de l'UE dans le domaine des maladies rares. Nous nous sommes attachés à répondre à la question suivante:
Les actions de l'UE en matière de soins de santé transfrontaliers profitent-elles aux patients?
67Nous estimons, en conclusion, que les actions de l'UE dans le domaine des soins de santé transfrontaliers étaient ambitieuses et ont permis de renforcer la coopération entre les États membres, mais qu'elles doivent être mieux gérées. L'impact sur les patients était limité au moment de notre audit.
68Nous avons constaté que la Commission surveillait convenablement la mise en œuvre de la directive dans les États membres (points 23 à 28) et soutenait dans leurs travaux les points de contact nationaux chargés d'informer les patients transfrontaliers. Elle a récemment élaboré une boîte à outils pratique à l'intention des PCN. Toutefois, les patients de l'UE se heurtent encore à des difficultés d'accès aux soins de santé à l'étranger, et les patients potentiels informés de leurs droits à bénéficier de soins de santé transfrontaliers sont peu nombreux. En raison de la complexité des parcours de soins transfrontaliers accessibles aux patients en vertu de la directive sur les soins de santé transfrontaliers et du règlement sur la coordination des systèmes de sécurité sociale, il est difficile de fournir aux patients des informations claires. Les sites web des PCN fournissent peu d'informations sur les réseaux européens de référence (points 29 à 32).
Recommandation n° 1 – Renforcer le soutien aux points de contact nationauxLa Commission devrait:
- s'appuyer sur des actions antérieures pour soutenir les travaux des points de contact nationaux, notamment en ce qui concerne la meilleure manière d'expliquer les liens entre les parcours prévus par la directive sur les soins de santé transfrontaliers et ceux prévus par le règlement sur la coordination des systèmes de sécurité sociale;
- fournir des orientations sur la présentation des informations concernant les réseaux européens de référence sur les sites web des points de contact nationaux;
- faire un suivi de l'utilisation, par les points de contact nationaux, de la boîte à outils de 2018.
Délai de mise en œuvre: 2020
69En 2018, la Commission a adopté une nouvelle stratégie en matière de santé en ligne sans avoir mis à jour le plan d'action actuel. Cette stratégie ne comporte pas de plan de mise en œuvre fixant les échéances pour les résultats et les réalisations attendus (points 34 à 37).
70Les travaux sur les échanges transfrontaliers de données de santé ont abouti à la création de normes d'interopérabilité. La Commission, en coopération avec les États membres, met actuellement en place une infrastructure (l'eHDSI) pour permettre ces échanges à l'échelle de l'UE. Elle n'a pas évalué le nombre probable de ses utilisateurs avant de lancer le projet. Les prévisions de la Commission sur le succès probable des échanges transfrontaliers de données de santé étaient trop optimistes. Le déploiement de l'eHDSI a connu des retards, et les échanges transfrontaliers de données de santé via cette infrastructure n'avaient pas commencé au moment de notre audit (points 38 à 47).
Recommandation n° 2 – Améliorer la préparation aux échanges transfrontaliers de données de santéLa Commission devrait:
- évaluer les résultats obtenus lors des échanges transfrontaliers de données de santé par l'intermédiaire de l'eHDSI (pour les ordonnances électroniques et les dossiers de patients informatisés);
- à la lumière de ces éléments, évaluer le plan d'action 2012 pour la santé en ligne et la mise en œuvre de la stratégie de 2018 en la matière, en examinant notamment si ces actions ont fourni en temps voulu des solutions d'un rapport coût-efficacité satisfaisant et si elles ont apporté une contribution utile aux systèmes nationaux de soins de santé.
Délai de mise en œuvre: 2021
Délai de mise en œuvre: 2021
Le lancement des réseaux européens de référence constitue une innovation ambitieuse dans le domaine de la coopération transfrontalière en matière de soins de santé, a fortiori dans un domaine comme la santé qui relève de la compétence des États membres. La Commission a équipé les réseaux mis en place du système de gestion clinique des patients afin de faciliter le partage de données relatives à ces derniers. Les réseaux européens de référence ayant été mis en place en mars 2017, il est encore trop tôt pour déterminer s'ils apportent une valeur ajoutée aux efforts déployés par les États membres pour offrir une meilleure prise en charge aux patients atteints de maladies rares.
72Nous avons constaté que la Commission n'avait pas fait le bilan des progrès accomplis dans la mise en œuvre de la stratégie de l'UE dans le domaine des maladies rares depuis 2014 (points 49 à 51). Le processus de mise en place des ERN et le soutien continu qui leur est apporté par la Commission présentent des insuffisances, et celle-ci n'a pas établi de plan de dépenses pour les réseaux. Les ERN sont confrontés à des défis de taille pour assurer leur viabilité financière et leur capacité à fonctionner efficacement au sein des systèmes nationaux de soins de santé et à l'interface entre ces systèmes. La Commission a donc encouragé les États membres à les intégrer dans leurs systèmes nationaux de soins de santé (points 52 à 62). Nous avons également relevé des retards dans le lancement de la plateforme européenne pour les registres de maladies rares (points 63 à 65).
Recommandation n° 3 – Améliorer le soutien destiné à faciliter l'accès aux soins des patients atteints de maladies raresLa Commission devrait:
- évaluer les résultats de la stratégie dans le domaine des maladies rares (y compris le rôle des réseaux européens de référence) et décider si cette stratégie doit être actualisée, adaptée ou remplacée;
- en concertation avec les États membres, proposer des moyens de relever les défis auxquels sont confrontés les réseaux européens de référence (y compris leur intégration dans les systèmes nationaux de soins de santé et les registres de patients);
- s'efforcer de simplifier la structure des futurs financements octroyés par l'UE aux réseaux européens de référence et réduire leur charge administrative.
Délai de mise en œuvre: 2023
Délai de mise en œuvre: 2020
Délai de mise en œuvre: 2022
Le présent rapport a été adopté par la Chambre I, présidée par M. Nikolaos MILIONIS, Membre de la Cour des comptes, à Luxembourg en sa réunion du 10 avril 2019.
Par la Cour des comptes

Klaus-Heiner Lehne
Président
Annexes
Annexe I – Comparaison des droits des patients en matière de soins de santé transfrontaliers au titre de la directive et au titre du règlement
| DIRECTIVE | RÈGLEMENT | |
|---|---|---|
| Secteur | Public + privé | Public uniquement |
| Traitements éligibles | Traitements disponibles dans le cadre du système d'assurance-maladie du pays d'affiliation du patient | Traitements disponibles dans le cadre du système d'assurance-maladie de l'autre pays |
| Autorisation préalable | Nécessaire dans certaines circonstances | Systématiquement nécessaire pour les soins programmés Pas nécessaire pour les situations d'urgence |
| Dépenses couvertes | Remboursement à hauteur du montant qui aurait été pris en charge si les soins avaient été dispensés dans l'État membre d'affiliation du patient | Remboursement intégral (sauf ticket modérateur) |
| Remboursement du ticket modérateur | À hauteur des coûts qui auraient été pris en charge dans l'État membre d'affiliation | Oui (sous certaines conditions) |
| Modalités de paiement | Les patients avancent les frais et sont remboursés plus tard (système de remboursement). | Entre les pays; les patients ne sont pas tenus d'avancer les frais (système de financement). |
| Pays éligibles | Tous les pays de l'UE et de l'EEE | Tous les pays de l'UE et de l'EEE + la Suisse |
Source: Cour des comptes européenne, sur la base du site web Healthcare beyond borders.
Annexe II – Calendrier du déploiement des échanges transfrontaliers de données de santé au sein de l'UE

Source Service Catalogue, Delivery and Overall Deployment – eHDSI – ePrescription and Patient Summary, accessible sur le site web de l'eHDSI46.
Annexe III – Liste des réseaux européens de référence
| Nom abrégé | Nom complet |
|---|---|
| Endo-ERN | Réseau européen de référence pour les maladies endocriniennes |
| ERKNet | Réseau européen de référence pour les maladies rénales |
| ERN BOND | Réseau européen de référence pour les maladies osseuses |
| ERN CRANIO | Réseau européen de référence sur les anomalies crâniofaciales et les maladies oto-rhino-laryngologiques |
| ERN EpiCARE | Réseau européen de référence pour les épilepsies |
| ERN EURACAN | Réseau européen de référence pour les cancers chez l'adulte (tumeurs solides) |
| ERN EuroBloodNet | Réseau européen de référence pour les hémopathies |
| ERN eUROGEN | Réseau européen de référence pour les maladies et pathologies urogénitales |
| ERN EURO-NMD | Réseau européen de référence pour les maladies neuromusculaires |
| ERN EYE | Réseau européen de référence pour les maladies oculaires |
| ERN Genturis | Réseau européen de référence pour les syndromes de prédisposition génétique aux tumeurs |
| ERN GUARD-Heart | Réseau européen de référence pour les maladies cardiaques |
| ERNICA | Réseau européen de référence pour les anomalies héréditaires et congénitales |
| ERN ITHACA | Réseau européen de référence pour les malformations congénitales et les handicaps intellectuels rares |
| ERN LUNG | Réseau européen de référence pour les maladies respiratoires |
| ERN TRANSPLANT-CHILD | Réseau européen de référence pour la transplantation chez l'enfant |
| ERN PaedCan | Réseau européen de référence pour les cancers de l'enfant (hémato-oncologie) |
| ERN RARE-LIVER | Réseau européen de référence pour les maladies hépatologiques |
| ERN ReCONNET | Réseau européen de référence pour les maladies des tissus conjonctifs et musculo-squelettiques |
| ERN RITA | Réseau européen de référence pour les maladies immunodéficitaires, les maladies auto-inflammatoires et les maladies auto-immunes |
| ERN-RND | Réseau européen de référence pour les maladies neurologiques |
| ERN Skin | Réseau européen de référence pour les maladies dermatologiques |
| MetabERN | Réseau européen de référence pour les troubles héréditaires du métabolisme |
| VASCERN | Réseau européen de référence pour les maladies vasculaires rares avec atteinte multisystémique |
Sigles et acronymes
DG SANTE: Direction générale de la santé et de la sécurité alimentaire
eHDSI: eHealth Digital Service Infrastructure, infrastructure européenne de services numériques dans le domaine de la santé en ligne
eHMSEG: eHDSI Member States Expert Group, groupe d'experts des États membres dans le domaine de la santé en ligne
epSOS: Smart Open Service for European Patients
ERN: European Reference Network, réseau européen de référence
EUCERD: European Union Committee of Experts on Rare Diseases, comité d'experts de l'Union européenne dans le domaine des maladies rares
JRC: Joint Research Centre, Centre commun de recherche de la Commission européenne
MIE: Mécanisme pour l'interconnexion en Europe
NCPeH: National Contact Point for eHealth, point de contact national en matière de santé en ligne
PCN: point de contact national
TFUE: Traité sur le fonctionnement de l'Union européenne
Glossaire
Coordonnateur de réseau européen de référence: chaque réseau compte un membre agissant en qualité de coordonnateur. Il facilite la coopération entre les membres du réseau.
Dossier de santé informatisé: dossier médical complet ou documentation similaire sur l'état de santé physique et mental passé et présent d'un individu, présentés sous forme électronique et permettant d'accéder facilement à ces données en vue d'un traitement médical et à d'autres fins étroitement liées
Interopérabilité: capacité de différents systèmes de santé d'utiliser et d'échanger des données entre eux afin d'interconnecter les informations
Maladie rare: une maladie ou un trouble est considéré comme rare dans l'Union européenne lorsqu'il touche moins de cinq personnes sur 10 000.
Ordonnance électronique (ePrescription): ordonnance de médicaments ou de traitements créée au format électronique au moyen d'un logiciel par un professionnel de santé légalement autorisé à le faire, et transmission par voie électronique des données de prescription à une pharmacie en mesure de délivrer le médicament
Réseaux européens de référence: réseaux virtuels réunissant des prestataires de soins de santé de toute l'Europe. Ils ont pour objectif de prendre en charge les patients atteints de maladies rares ou complexes qui nécessitent un traitement hautement spécialisé et une concentration des connaissances et des ressources.
Santé en ligne: utilisation des technologies de l'information et de la communication dans les produits, services et processus médicaux, combinée à des changements organisationnels dans les systèmes de soins de santé et à de nouvelles compétences. La santé en ligne est le transfert de soins de santé par voie électronique.
Soins de santé transfrontaliers: soins de santé dispensés ou prescrits hors de l'État membre d'affiliation de l'assuré
Notes
1 Directive 2011/24/UE du Parlement européen et du Conseil du 9 mars 2011 relative à l'application des droits des patients en matière de soins de santé transfrontaliers (JO L 88 du 4.4.2011, p. 45).
2 Article 168 du traité sur le fonctionnement de l'UE (TFUE).
3 Règlement (CE) n° 883/2004 du Parlement européen et du Conseil du 29 avril 2004 sur la coordination des systèmes de sécurité sociale (JO L 166 du 30.4.2004, p. 1). Ce règlement porte sur les aspects des soins de santé transfrontaliers en rapport avec la mobilité des travailleurs et le tourisme, ainsi que sur les liens entre ces aspects et les systèmes de santé et de sécurité sociale.
4 D'après les résultats de l'enquête menée auprès des PCN par le groupe d'experts sur les soins de santé transfrontaliers en mai 2017 et confirmés par la Cour lors de sa propre enquête auprès des membres de ce même groupe.
5 Rapport de la Commission sur l'application de la directive 2011/24/UE relative à l'application des droits des patients en matière de soins de santé transfrontaliers (COM(2018) 651 final).
6 Annexe B du rapport de la Commission sur l'application de la directive 2011/24/UE (COM(2018) 651 final).
7 La coopération territoriale européenne (CTE), mieux connue sous le nom d'Interreg, est l'un des deux objectifs de la politique de cohésion de l'UE et constitue un cadre dans lequel les parties prenantes nationales, régionales et locales de différents États membres peuvent mener des actions communes et échanger des politiques.
8 Study on Cross-Border Cooperation. Capitalising on existing initiatives for cooperation in cross-border regions, étude de la Commission publiée en mars 2018. La liste des projets recensés par l'étude et de leurs objectifs est accessible en ligne ici.
9 Communication de la Commission «Permettre la transformation numérique des services de santé et de soins dans le marché unique numérique; donner aux citoyens les moyens d'agir et construire une société plus saine», COM(2018) 233 final du 25.4.2018. La communication a été établie à la suite de l'examen à mi-parcours de la stratégie pour un marché unique numérique.
10 La Belgique, la Tchéquie, l'Allemagne, l'Estonie, l'Irlande, la Grèce, l'Espagne, la France, la Croatie, l'Italie, Chypre, la Lituanie, le Luxembourg, la Hongrie, Malte, les Pays-Bas, l'Autriche, la Pologne, le Portugal, la Slovénie, la Finlande et la Suède.
11 Dix États membres (la Croatie, la République tchèque, le Danemark, l'Estonie, la Finlande, la Grèce, l'Italie, le Portugal, l'Espagne et la Suède) ont déclaré une couverture nationale de plus de 90 % pour les ordonnances électroniques en 2017.
12 epSOS – Smart Open Service for European Patients, un projet financé au titre du troisième volet du programme pour l'innovation et la compétitivité (PIC): des services de santé durables et interopérables.
13 Recommandation du Conseil du 8 juin 2009 relative à une action dans le domaine des maladies rares.
14 Le conseil des États membres en charge des ERN a été créé en vertu de la décision d'exécution 2014/287/UE de la Commission du 10 mars 2014 établissant les critères de mise en place et d'évaluation des réseaux européens de référence et de leurs membres et de facilitation des échanges d'informations et de connaissances liées à la mise en place de ces réseaux et à leur évaluation (JO L 147 du 17.5.2014, p. 79).
15 Stratégie de la Cour pour la période 2018‑2020.
16 Le Danemark, l'Italie, la Lituanie, les Pays-Bas et la Suède.
17 Directive d'exécution 2012/52/UE de la Commission du 20 décembre 2012 établissant des mesures visant à faciliter la reconnaissance des prescriptions médicales établies dans un autre État membre (JO L 356 du 22.12.2012, p. 68).
18 Article 20 de la directive.
19 Parmi ces études, on citera: une étude de 2012 intitulée A best practice based approach to National Contact Point websites adressant des recommandations aux États membres et à la Commission sur la manière de communiquer, par l'intermédiaire des PCN, les informations appropriées sur différents aspects essentiels des soins de santé transfrontaliers; une étude de 2014 intitulée Study on the impact of information on patients' choice within the context of the Directive; et une étude de 2015 portant sur l'évaluation de l'application de la directive, comportant notamment un examen des sites web des PCN.
20 Selon une enquête menée auprès des PCN par la Commission dans le cadre de son rapport sur l'application de la directive.
21 Étude sur les services de santé transfrontaliers: améliorer l'accès des patients aux informations publiée le 20 juillet 2018.
22 Rapport du 29 janvier 2019 sur la mise en œuvre de la directive sur les soins de santé transfrontaliers, Commission de l'environnement, de la santé publique et de la sécurité alimentaire.
23 Compte rendu de la réunion des PCN du 5 mai 2017.
24 Communication de la Commission «Permettre la transformation numérique des services de santé et de soins dans le marché unique numérique; donner aux citoyens les moyens d'agir et construire une société plus saine», COM(2018) 233 final du 25.4.2018. La communication a été établie à la suite de l'examen à mi-parcours de la stratégie pour un marché unique numérique.
25 Évaluation intermédiaire du plan d'action pour la santé en ligne 2012‑2020, étude réalisée par Deloitte pour la Commission.
26 Le budget total du projet s'élevait à 38 millions d'euros, que l'UE a accepté de cofinancer à hauteur de 18 millions d'euros. Au total, 24 pays ont participé au projet.
27 Ce montant englobe les services informatiques destinés aux ERN.
28 Rapport sur l'examen technique final du projet epSOS du 12 novembre 2014.
29 En 2014, l'unité «Systèmes d'information» de la DG SANTE a réalisé une évaluation du projet epSOS afin d'obtenir une vue d'ensemble de ses résultats et de ses réalisations et de faire une synthèse des conclusions concernant la maturité du projet en vue d'une éventuelle mise en œuvre à grande échelle.
30 Site web de la Commission: Cross-border digital prescription and patient data exchange are taking off.
31 Site web de la Commission: eHDSI governance.
32 Annexe du rapport annuel d'activité 2016 de la DG Santé et sécurité alimentaire. Dans son rapport annuel d'activité 2017, le chiffre communiqué par la Commission est tombé à neuf États membres, le Danemark s'étant retiré des services d'information transfrontaliers dans le domaine de la santé en ligne (voir point 10 et encadré 1).
33 La Tchéquie, l'Estonie, la Croatie, le Luxembourg, Malte, le Portugal et la Finlande.
34 Communication de la Commission intitulée «Les maladies rares: un défi pour l'Europe», COM(2008) 679 final.
35 Recommandation du Conseil du 8 juin 2009 relative à une action dans le domaine des maladies rares.
36 Comité d'experts de l'Union européenne dans le domaine des maladies rares (EUCERD) créé par la décision de la Commission européenne du 30 novembre 2009 (2009/872/CE).
37 La Commission a établi le cadre de ces travaux dans la décision d'exécution et la décision déléguée du 10 mars 2014.
38 Dans son rapport annuel d'activité 2016 (annexe A, p. 169), la DG SANTE indique une valeur intermédiaire de dix réseaux sous l'indicateur de résultat 1.5.A: nombre de réseaux européens de référence mis en place.
39 Article 4, paragraphe 5, de la décision d'exécution 2014/287/UE de la Commission du 10 mars 2014.
40 Nous avons constaté que 30 des 50 prestataires de soins de santé provenant de 23 ERN dont le rapport d'examen figurait dans notre échantillon n'avaient pas fait mention d'un plan d'action clair.
41 Article 14 de la décision d'exécution 2014/287/UE de la Commission du 10 mars 2014.
42 Troisième programme Santé.
43 Conseil des États membres en charge des ERN, 6 mars 2018.
44 Sur la base de l'accord administratif conclu entre la DG SANTE et le JRC.
45 Les réseaux EUROCAT (European Surveillance of Congenital Anomalies, réseau européen de surveillance des anomalies congénitales) et SCPE (Surveillance of Cerebral Palsy in Europe, réseau de surveillance de la paralysie cérébrale en Europe).
46 En novembre 2018, le réseau «santé en ligne» a autorisé la mise en service des échanges transfrontaliers de données de santé par l'intermédiaire de l'eHDSI pour quatre États membres. La Finlande peut transmettre des ordonnances électroniques, tandis que l'Estonie peut en recevoir. La Tchéquie et le Luxembourg sont désormais autorisés à recevoir de l'étranger des dossiers de patients informatisés, mais aucun État membre ne peut encore en transmettre via l'eHDSI. Trois États membres (la Croatie, Malte et le Portugal) prévoient de demander la mise en service au cours du premier trimestre de 2019.
47 Chaque État membre participant à l’eHDSI a reçu un financement du volet «Télécommunications» du MIE pour mettre en place son point de contact national en matière de santé en ligne et se lancer dans l’échange transfrontalier de données de santé. Le calendrier de la mise en œuvre au niveau national fait partie d’une convention de subvention signée par chaque État membre avec la Commission.
48 Les quatre pays autorisés par le réseau «Santé en ligne» à procéder à la mise en service en novembre 2018 prévoient de déployer plus d’un service (l’envoi et la réception d'ordonnances en ligne constituent deux services différents): i) la Finlande a commencé à envoyer des ordonnances électroniques et prévoit de commencer à en recevoir d’ici fin 2019; ii) l’Estonie a commencé à recevoir des ordonnances électroniques et prévoit de commencer à en envoyer d’ici fin 2019; iii) la République tchèque est prête tant à envoyer qu'à recevoir des dossiers de patients et prévoit de commencer à envoyer et à recevoir des ordonnances électroniques d'ici fin 2020; iv) le Luxembourg est prêt à recevoir des dossiers de patients et prévoit de commencer à en envoyer d'ici fin 2019. Il prévoit également de commencer à envoyer des ordonnances électroniques d'ici fin 2020.
Le 11 mars, le groupe d’experts des États membres dans le domaine de la santé en ligne (eHMSEG) s'est prononcé en faveur de la mise en service des échanges d'ordonnances électroniques (tant l'envoi que la réception) et de dossiers de patients (réception) par la Croatie, une fois que les auditeurs auraient confirmé la mise en œuvre réussie de la dernière mesure correctrice en suspens. Cette recommandation doit être adoptée par le réseau «Santé en ligne» pour devenir effective.
49 https://eur-lex.europa.eu/legal-content/FR/TXT/HTML/?uri=CELEX:12012E/TXT&from=EN
50 À noter en particulier: 1) les conclusions du projet pilote «Rares 2030» financé par le Parlement européen, qui visent à soutenir les futures décisions stratégiques, à examiner la faisabilité de nouvelles approches et à proposer des recommandations stratégiques (résultats attendus début 2021); 2) l’évaluation du troisième programme pour la santé (attendue pour le milieu de l’année 2021); 3) l’évaluation de la directive 2011/24/UE relative à l’application des droits des patients en matière de soins de santé transfrontaliers (prévue pour fin 2022); 4) l’évaluation du programme-cadre pour la recherche et l’innovation «Horizon 2020» (date à confirmer).
51 https://ec.europa.eu/health/sites/health/files/cross_border_care/docs/2018_crossborder_frep_en.pdf
Équipe d'audit
Les rapports spéciaux de la Cour présentent les résultats de ses audits relatifs aux politiques et programmes de l'UE ou à des questions de gestion concernant des domaines budgétaires spécifiques. La Cour sélectionne et conçoit ces activités d'audit de manière à maximiser leur incidence en tenant compte des risques pour la performance ou la conformité, du niveau des recettes ou des dépenses concernées, des évolutions escomptées ainsi que de l'importance politique et de l'intérêt du public.
Le présent audit de la performance a été réalisé par la Chambre I, présidée par M. Nikolaos Milionis, Membre de la Cour, et compétente pour les domaines de dépenses relatifs à l'utilisation durable des ressources naturelles. L'audit a été effectué sous la responsabilité de M. Janusz Wojciechowski, Membre de la Cour. Il était assisté de: Mmes Kinga Wiśniewska-Danek, chef de cabinet, et Katarzyna Radecka-Moroz, attachée de cabinet; M. Colm Friel, manager principal; Mme Joanna Kokot, chef de mission; M. Nicholas Edwards, chef de mission adjoint; MM. Frédéric Soblet et Aris Konstantinidis, Mmes Anna Zalega, Michela Lanzutti et Jolanta Zemailaite, auditeurs. L'assistance linguistique a été assurée par M. Mark Smith.

De gauche à droite: Frédéric Soblet, Kinga Wiśniewska-Danek, Aris Konstantinidis, Janusz Wojciechowski, Colm Friel, Joanna Kokot, Nicholas Edwards et Jolanta Zemailaite.
Contact
COUR DES COMPTES EUROPÉENNE
12, rue Alcide De Gasperi
1615 Luxembourg
LUXEMBOURG
Tél. +352 4398-1
Contact: eca.europa.eu/fr/Pages/ContactForm.aspx
Site internet: eca.europa.eu
Twitter: @EUAuditors
De nombreuses autres informations sur l’Union européenne sont disponibles sur l’internet via le serveur Europa (http://europa.eu).
Luxembourg: Office des publications de l’Union européenne, 2019
| ISBN 978-92-847-1930-3 | ISSN 1977-5695 | doi:10.2865/46735 | QJ-AB-19-005-FR-N | |
| HTML | ISBN 978-92-847-1911-2 | ISSN 1977-5695 | doi:10.2865/578672 | QJ-AB-19-005-FR-Q |
© Union européenne, 2019
Toute utilisation ou reproduction de photos ou de tout autre matériel dont la Cour des comptes européenne ne possède pas les droits d'auteur requiert l'autorisation préalable des titulaires des droits en question.
COMMENT PRENDRE CONTACT AVEC L’UNION EUROPÉENNE?
En personne
Dans toute l’Union européenne, des centaines de centres d’information Europe Direct sont à votre disposition. Pour connaître l’adresse du centre le plus proche, visitez la page suivante: https://europa.eu/european-union/contact_fr
Par téléphone ou courrier électronique
Europe Direct est un service qui répond à vos questions sur l’Union européenne. Vous pouvez prendre contact avec ce service:
- par téléphone:
- via un numéro gratuit: 00 800 6 7 8 9 10 11 (certains opérateurs facturent cependant ces appels),
- au numéro de standard suivant: +32 22999696;
- par courrier électronique via la page https://europa.eu/european-union/contact_fr
COMMENT TROUVER DES INFORMATIONS SUR L’UNION EUROPÉENNE?
En ligne
Des informations sur l’Union européenne sont disponibles, dans toutes les langues officielles de l’UE, sur le site internet Europa à l’adresse https://europa.eu/european-union/contact_fr
Publications de l’Union européenne
Vous pouvez télécharger ou commander des publications gratuites et payantes à l’adresse https://op.europa.eu/fr/publications. Vous pouvez obtenir plusieurs exemplaires de publications gratuites en contactant Europe Direct ou votre centre d’information local (https://europa.eu/european-union/contact_fr).
Droit de l’Union européenne et documents connexes
Pour accéder aux informations juridiques de l’Union, y compris à l’ensemble du droit de l’UE depuis 1952 dans toutes les versions linguistiques officielles, consultez EUR-Lex à l’adresse suivante: http://eur-lex.europa.eu
Données ouvertes de l’Union européenne
Le portail des données ouvertes de l’Union européenne (http://data.europa.eu/euodp/fr) donne accès à des ensembles de données provenant de l’UE. Les données peuvent être téléchargées et réutilisées gratuitement, à des fins commerciales ou non commerciales.
 Rapport spécial
Rapport spécial