
Le azioni intraprese dall’UE in materia di assistenza sanitaria transfrontaliera sono molto ambiziose, ma devono essere gestite meglio
(presentata in virtù dell’articolo 287, paragrafo 4, secondo comma, del TFUE)
Contenuto della relazione: La direttiva del 2011 sull’assistenza sanitaria transfrontaliera mira ad assicurare ai pazienti UE il diritto di accedere ad un’assistenza sanitaria sicura e di alta qualità, anche oltre i confini nazionali, all’interno dell’UE. Vuole inoltre facilitare una più stretta collaborazione tra Stati membri in materia di assistenza sanitaria on-line (eHealth) e la cura delle malattie rare. La Corte ha concluso che, sebbene le azioni intraprese dall’UE in materia di assistenza sanitaria transfrontaliera abbiano accresciuto la collaborazione tra Stati membri, i benefici per i pazienti sono limitati. Nonostante i progressi compiuti nel fornire ai cittadini UE informazioni sull’assistenza sanitaria transfrontaliera, la Corte ha rilevato che in alcuni ambiti l’accesso a tali informazioni resta difficile. La Corte ha individuato debolezze nella pianificazione strategia e nella gestione dei progetti della Commissione. La Corte formula raccomandazioni riguardanti soprattutto il sostegno della Commissione ai punti di contatto nazionali, la realizzazione degli scambi transfrontalieri di dati sanitari e le azioni dell’UE nel campo delle malattie rare.
Sintesi
IAnche se l’assistenza sanitaria transfrontaliera resta marginale rispetto a quella fornita all’interno degli Stati membri, in alcune situazioni l’assistenza più accessibile o adeguata per i pazienti è disponibile unicamente in uno Stato membro diverso dal loro paese di affiliazione. Per i pazienti, la possibilità di poter decidere liberamente e consapevolmente di ricorrere all’assistenza sanitaria transfrontaliera può contribuire a migliorare la loro salute.
IINel 2011 la direttiva sull’assistenza sanitaria transfrontaliera ha voluto stabilire il diritto dei pazienti UE ad accedere ad un’assistenza sanitaria sicura e di alta qualità oltre i confini nazionali, all’interno dell’UE, e il diritto ad essere rimborsati per detta assistenza. La direttiva favorisce una maggiore cooperazione in diversi ambiti, in particolare lo scambio transfrontaliero dei dati sanitari dei pazienti e l’accesso all’assistenza sanitaria per i pazienti affetti da malattie rare.
IIICirca 200 000 pazienti traggono vantaggio ogni anno dai sistemi istituiti in virtù della direttiva per ricevere cure sanitarie all’estero: meno dello 0,05 % dei cittadini dell’UE. Negli ultimi anni, la Francia ha registrato il più alto numero di pazienti in uscita e la Spagna il più alto numero di pazienti in entrata. La maggior parte della mobilità dei pazienti avviene tra Stati membri confinanti.
IVLa Corte ha esaminato se la Commissione abbia vigilato adeguatamente sull’attuazione della direttiva negli Stati membri e abbia fornito orientamenti ai punti di contatto nazionali responsabili di informare i pazienti sul loro diritto all’assistenza sanitaria transfrontaliera. La Corte ha verificato se i risultati raggiunti in materia di scambi transfrontalieri di dati sanitari dei pazienti fossero all’altezza delle aspettative e se avessero comportato benefici concreti per i pazienti. Ha esaminato inoltre importanti azioni recenti dell’UE nel campo delle malattie rare, focalizzate sulla creazione delle reti di riferimento europee. Queste reti hanno lo scopo di favorire la condivisione di conoscenze e fornire consulenza per la diagnosi e la cura, attraverso consultazioni virtuali tra prestatori di assistenza sanitaria in Europa, migliorando così il livello dell’assistenza.
VLa Corte ha concluso che, anche se le azioni intraprese dall’UE nel settore dell’assistenza sanitaria transfrontaliera hanno accresciuto la cooperazione tra Stati membri, al momento dell’audit l’impatto sui pazienti era limitato. Queste azioni sono ambiziose e devono essere meglio gestite.
VILa Commissione ha vigilato sull’attuazione della direttiva sull’assistenza sanitaria transfrontaliera in modo adeguato. Ha fornito direttive ai punti di contatto nazionali in modo che questi fornissero migliori informazioni sull’assistenza sanitaria transfrontaliera, ma vi sono margini di miglioramento.
VIIAl momento dell’audit, non vi era stato alcuno scambio di dati sanitari dei pazienti fra Stati membri e non era possibile confermare che i pazienti transfrontalieri avessero tratto qualche beneficio da tali scambi. La Commissione non ha definito un piano e la relativa la tempistica per l’attuazione della propria strategia in materia di assistenza sanitaria on-line, né ha stimato i volumi dei potenziali utenti prima di attivare gli scambi di dati sanitari transfrontalieri.
VIIIIl concetto di reti di riferimento europee per le malattie rare trovava ampio sostegno presso le parti interessate dell’UE (organizzazioni dei pazienti, medici e prestatori di assistenza sanitaria). La Commissione non ha però specificato con chiarezza come tali reti sarebbero state finanziate in futuro né come avrebbero dovuto essere sviluppate ed integrate nei sistemi sanitari nazionali.
IXAlla luce delle conclusioni raggiunte, la Corte formula raccomandazioni riguardanti soprattutto il sostegno fornito dalla Commissione ai punti di contatto nazionali, l’attuazione degli scambi transfrontalieri di dati sanitari e l’azione dell’UE nel campo delle malattie rare.
Introduzione
01La direttiva sull’assistenza sanitaria transfrontaliera (nel prosieguo, “la direttiva”1):
- stabilisce il diritto dei pazienti UE ad accedere a un’assistenza sanitaria sicura e di alta qualità oltre i confini nazionali, all’interno dell’UE, e il diritto ad essere rimborsati per detta assistenza;
- istituisce punti di contatto nazionali per fornire ai cittadini informazioni sui loro diritti relativi all’assistenza sanitaria transfrontaliera;
- intende facilitare una più stretta cooperazione in materia di assistenza sanitaria on-line, compresi gli scambi transfrontalieri di dati dei pazienti e
- mira a facilitare l’accesso dei pazienti affetti da malattie rare all’assistenza sanitaria, soprattutto grazie allo sviluppo delle reti di riferimento europee (ERN).
Diritti dei pazienti relativi all’assistenza sanitaria transfrontaliera
02L’assistenza sanitaria è una competenza nazionale e gli Stati membri finanziano, gestiscono ed organizzano i propri sistemi sanitari2. La direttiva stabilisce le condizioni in base alle quali un paziente può recarsi in un altro paese UE per ricevere assistenza medica programmata, che verrà rimborsata alle stesse condizioni applicate nello Stato membro di affiliazione. Disciplina i costi dell’assistenza sanitaria, nonché le prescrizioni e la fornitura di medicinali e dispositivi medici, e completa il quadro giuridico già istituito dal regolamento UE sul coordinamento dei sistemi di sicurezza sociale3 (cfr. allegato I) per il confronto tra i diritti dei pazienti previsti dalla direttiva e dal regolamento). La direttiva mira a facilitare l’accesso a un’assistenza sanitaria transfrontaliera di elevata qualità, in base alla scelta libera e informata dei pazienti, poiché in alcune situazioni l’assistenza più accessibile o adeguata per i pazienti è disponibile unicamente in uno Stato membro diverso dal loro paese di affiliazione. La direttiva non incoraggia però i pazienti a ricevere cure all’estero.
03I pazienti che intendono ricevere assistenza sanitaria in un altro Stato membro hanno diritto a ricevere le pertinenti informazioni sugli standard di cura, sulle regole di rimborso e sui migliori canali previsti dalla normativa per accedervi. Ogni punto di contatto nazionale dovrebbe fornire queste informazioni. Gli Stati membri possono richiedere una autorizzazione preventiva per taluni tipi di assistenza sanitaria, principalmente per trattamenti che comportano il ricovero per almeno una notte o l’utilizzo di infrastrutture o apparecchiature altamente specializzate. Ciò avviene in circa l’1 % dei casi.
04La direttiva conferma che i pazienti che intendono recarsi all’estero per ricevere assistenza sanitaria dovrebbero essere rimborsati per questa assistenza dal loro paese di affiliazione, a condizione che abbiano diritto all’assistenza sanitaria in tale paese. Il livello dei rimborsi per cure ricevute all’estero è fissato al livello dei costi che sarebbero stati sostenuti nel paese di affiliazione. È ampiamente riconosciuto che l’obbligo del pagamento anticipato delle spese da parte dei pazienti, pur intrinseco nella concezione della direttiva, rappresenta una sfida significativa per i pazienti4. Tuttavia, in base alla direttiva, gli Stati membri hanno l’opzione di fornire ai pazienti una stima dei costi sanitari.
05Il numero di cittadini che richiede il rimborso delle spese sostenute per assistenza medica ricevuta all’estero in virtù della direttiva è modesto (circa 200 000 domande all’anno – meno dello 0,05 % dei cittadini dell’UE) rispetto a quello dei cittadini che lo richiedono a norma del regolamento sul coordinamento dei sistemi di sicurezza sociale (circa 2 milioni di domande all’anno per cure all’estero non programmate). La spesa per l’assistenza sanitaria transfrontaliera sostenuta ai sensi della direttiva è stimata allo 0,004 % del bilancio annuale per l’assistenza sanitaria a livello dell’Unione5. Un’indagine Eurobarometro del 2015 indicava che meno del 20 % dei cittadini conosceva i propri diritti in materia di assistenza sanitaria transfrontaliera. La Commissione non dispone di dati più recenti sul grado di informazione dei cittadini riguardo alla direttiva.
06Il ricorso alla direttiva varia da uno Stato membro all’altro. Per i servizi di assistenza sanitaria che non richiedono una autorizzazione preventiva, la Francia conta il maggior numero di pazienti in uscita (quasi 150 000 pazienti nel 2016), mentre Spagna, Portogallo e Belgio sono i paesi che curano il maggior numero di pazienti esteri6. La tabella 1 mostra la mobilità dei pazienti in tutti i paesi dell’UE e del SEE nel 2016 ai sensi della direttiva, includendo sia i servizi che i prodotti sanitari. Le cifre includono la mobilità dei pazienti per trattamenti non soggetti ad autorizzazione preventiva (in totale 209 534 pazienti) e quella per trattamenti soggetti ad autorizzazione preventiva (in totale 3 562 pazienti).
Tabella 1 – Mobilità dei pazienti ai sensi della direttiva nel 2016
| Pazienti in uscita nel 2016 | |
|---|---|
| Paese | Numero di pazienti |
| FRANCIA | 146 054 |
| DANIMARCA | 25 343 |
| FINLANDIA | 11 427 |
| NORVEGIA | 10 301 |
| POLONIA | 8 647 |
| SLOVACCHIA | 6 110 |
| SLOVENIA | 1 835 |
| REGNO UNITO | 1 113 |
| IRLANDA | 791 |
| CECHIA | 401 |
| LUSSEMBURGO | 277 |
| ITALIA | 201 |
| CROAZIA | 200 |
| ROMANIA | 130 |
| ESTONIA | 80 |
| ISLANDA | 53 |
| BELGIO | 30 |
| LETTONIA | 27 |
| LITUANIA | 19 |
| CIPRO | 13 |
| SPAGNA | 11 |
| GRECIA | 10 |
| AUSTRIA | 9 |
| BULGARIA | 5 |
| PORTOGALLO | 5 |
| MALTA | 4 |
| GERMANIA | Nessun dato |
| UNGHERIA | Nessun dato |
| PAESIBASSI | Nessun dato |
| SVEZIA | Nessun dato |
| Totale | 213 096 |
| Pazienti in entrata nel 2016 | |
|---|---|
| Paese | Numero di pazienti |
| SPAGNA | 46 138 |
| PORTOGALLO | 32 895 |
| BELGIO | 27 457 |
| GERMANIA | 27 034 |
| LUSSEMBURGO | 12 530 |
| CECHIA | 12 300 |
| ESTONIA | 10 044 |
| ITALIA | 9 335 |
| POLONIA | 6 545 |
| SVEZIA | 6 162 |
| GRECIA | 5 639 |
| UNGHERIA | 4 169 |
| AUSTRIA | 2 437 |
| CROAZIA | 1 680 |
| PAESIBASSI | 1 653 |
| REGNO UNITO | 1 646 |
| ROMANIA | 1 003 |
| BULGARIA | 686 |
| IRLANDA | 674 |
| MALTA | 463 |
| FINLANDIA | 403 |
| FRANCIA | 371 |
| LITUANIA | 369 |
| NORVEGIA | 327 |
| SLOVACCHIA | 259 |
| CIPRO | 254 |
| DANIMARCA | 198 |
| LETTONIA | 167 |
| ISLANDA | 141 |
| SLOVENIA | 117 |
| Totale | 213 096 |
Fonte: Corte dei conti europea, sulla base della relazione “Member State data on cross-border patient healthcare following Directive 2011/24/EU – Year 2016” disponibile sul sito Internet della Commissione.
07La Commissione sostiene la cooperazione transfrontaliera in materia di assistenza sanitaria attraverso numerosi studi e iniziative, tra cui Interreg7, finanziato nell’ambito dei Fondi strutturali e di investimento europei. Gli Stati membri sono responsabili della gestione dei propri sistemi sanitari e per eventuali accordi di cooperazione tra Stati membri. Tali accordi spesso sono stipulati senza coinvolgere la Commissione. Il recente studio della Commissione sulle attività e sugli investimenti dell’UE nella cooperazione transfrontaliera in materia di assistenza sanitaria ha individuato 423 progetti finanziati dall’UE8 a sostegno di iniziative di collaborazione transfrontaliere nel settore sanitario nel periodo 2007‑2017.
Scambi transfrontalieri di dati sanitari
08La direttiva incarica la Commissione di sostenere la cooperazione tra gli Stati membri in materia di assistenza sanitaria on-line e istituisce una rete volontaria di autorità degli Stati membri (rete eHealth) per sostenere la definizione di misure comuni per il trasferimento dei dati nell’assistenza sanitaria transfrontaliera. eHealth è anche una parte fondamentale della strategia della Commissione europea per il mercato unico digitale e il suo sviluppo nell’UE è strutturato sulla base delle azioni indicate nei piani d’azione della Commissione per l’eHealth e nella strategia per l’eHealth del 20189. La Commissione ha anche istituito una task force nel 2017 che esamina gli incentivi e gli ostacoli alla sicurezza dello scambio transfrontaliero di dati sanitari in tutta l’UE.
09La Commissione, insieme agli Stati membri, sta creando una infrastruttura volontaria a livello UE di servizi digitali per l’eHealth (eHealth Digital Service Infrastructure, eHDSI), per consentire lo scambio di dati sanitari dei pazienti, in particolare le prescrizioni elettroniche e i fascicoli sanitari dei pazienti, attraverso le frontiere nazionali. Questo progetto coinvolge 22 Stati membri10 e mira a collegare i loro sistemi di eHealth all’infrastruttura eHealth dell’UE attraverso un portale dedicato, noto come “Punto nazionale di contatto per l’eHealth” (NCPeH) (cfr. figura 1, che illustra la procedura per lo scambio transfrontaliero di prescrizioni elettroniche).
Figura 1
Scambio transfrontaliero di una prescrizione elettronica

Fonte: Corte dei conti europea.
In alcuni Stati membri11, l’uso delle prescrizioni elettroniche è diffuso. Altri Stati membri hanno però avviato solo di recente progetti pilota o l’attuazione dei servizi per le prescrizioni elettroniche. La ridotta disponibilità di servizi eHealth a livello nazionale è una delle principali sfide connesse alla realizzazione dell’infrastruttura eHealth in tutta l’UE. Inoltre, alcuni Stati membri non partecipano affatto (ad esempio, la Danimarca, cfr. riquadro 1 sulle applicazioni eHealth per i pazienti) o partecipano solo ad alcuni servizi dell’infrastruttura UE per l’eHealth.
Riquadro 1
Applicazioni eHealth per i pazienti in Danimarca
Il portale nazionale eHealth – Sundhed.dk (https://www.sundhed.dk) consente ai pazienti danesi di accedere ai loro profili di trattamento farmacologico, vedere le consultazioni programmate con i fornitori di assistenza sanitaria e riordinare alcuni farmaci autonomamente. Nel 2018, le autorità danesi stavano lavorando ad un progetto pilota per aggiungere alcune funzioni al portale eHealth in modo da facilitare la fissazione degli appuntamenti per i pazienti che consultano frequentemente il medico (ad esempio, i pazienti con patologie croniche).
Inoltre, l’applicazione per dispositivi mobili “Medicinkortet” consente ai pazienti di richiedere una estensione per le prescrizioni digitali esistenti. Tutte le prescrizioni mediche emesse in Danimarca sono digitali.
L’UE finanzia l’infrastruttura eHealth attraverso il Meccanismo per collegare l’Europa, sulla base di un progetto pilota per lo scambio transfrontaliero di dati sanitari12. Gli Stati membri che desiderano iniziare a scambiare dati sanitari oltre frontiera devono completare una procedura di collaudo e audit, in esito alla quale un gruppo di esperti degli Stati membri (eHMSEG) formula una raccomandazione. La rete eHealth adotta la decisione finale su quali paesi possono attivare lo scambio transfrontaliero di dati sanitari.
Iniziative transfrontaliere per i pazienti affetti da malattie rare
12La direttiva definisce “malattie rare” le malattie che colpiscono non più di cinque persone su 10 000. Si stima che oggi vi siano tra 6 000 e 8000 malattie rare che colpiscono tra il 6 % e l’8 % della popolazione UE, ossia tra 27 e 36 milioni di persone. Le peculiarità delle malattie rare – un numero limitato di pazienti e scarsità di conoscenze e competenze in materia – hanno portato il Consiglio dell’Unione europea a sottolineare come la cooperazione in questo settore costituisca “un ambito unico cui l’intervento a livello comunitario può apportare un elevatissimo valore aggiunto”13.
13La Commissione ha presentato uno specifico quadro di intervento per la lotta alle malattie rare, in particolare attraverso la creazione delle reti europee di riferimento, nella sua comunicazione del 2008 “Le malattie rare: una sfida per l’Europa”. La direttiva dà incarico alla Commissione di sostenere gli Stati membri per lo sviluppo delle ERN. La figura 2 mostra le tappe che hanno portato alla costituzione delle ERN.
Figura 2
Tappe che hanno portato alla costituzione delle reti europee di riferimento
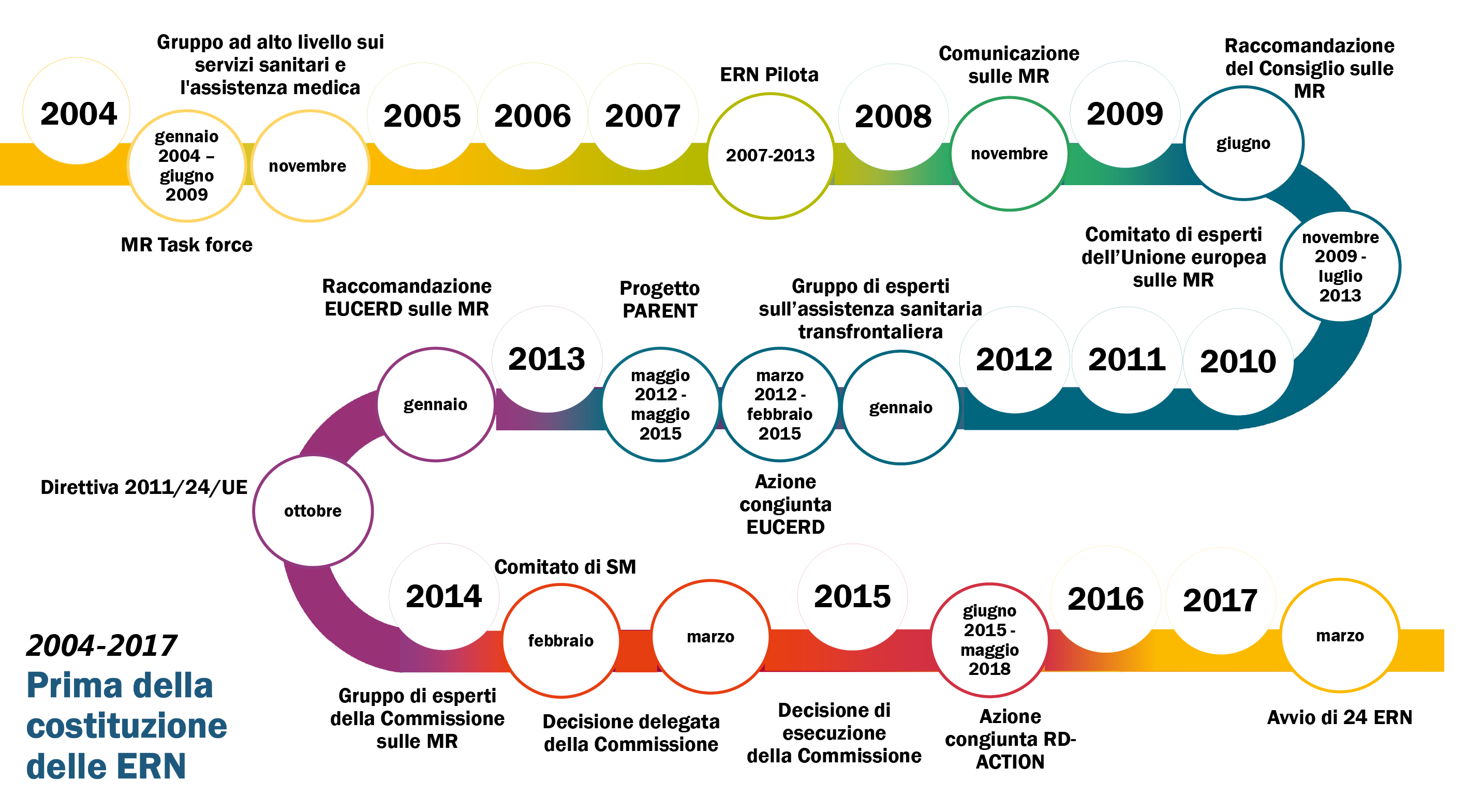
Fonte: Corte dei conti europea.
Le ERN mirano a ridurre i tempi delle diagnosi e migliorare l’accesso a cure adeguate per i pazienti affetti da malattie rare e a fornire piattaforme per l’elaborazione di orientamenti, lo sviluppo di corsi di formazione e la condivisione delle conoscenze. Nel 2017, sono state create 24 reti per diverse classi di malattie rare. Ciascuna riceve 1 milione di euro di finanziamenti per cinque anni dal programma UE Salute. La Commissione finanzia anche i registri dei pazienti e sostiene le attività delle ERN, nonché lo sviluppo degli strumenti informatici, in particolare attraverso il meccanismo per collegare l’Europa (MCE)
15Quando il caso di un paziente è segnalato in una ERN, viene convocato un panel “virtuale” di medici esperti attraverso il Sistema di gestione clinica del paziente (CPMS), una applicazione internet fornita dalla Commissione nel novembre 2017. Questa applicazione consente ai medici di condividere informazioni, dati e immagini sui singoli pazienti, previo consenso di questi ultimi, e di ricevere consulenza per la diagnosi e la cura. Il 73 % dei membri dell’ERN si era registrato per utilizzare l’applicazione e a dicembre 2018 erano stati creati 333 panel (cfr. riquadro 2 che mostra esempi di casi di pazienti affetti da malattie rare per i quali vi è stata una consultazione via ERN).
Riquadro 2
Esempi di casi di pazienti affetti da malattie rare per i quali vi è stata una consultazione via ERN
Nel 2018, all’ERN sui tumori pediatrici è stato sottoposto il caso di due bambini lituani con un tumore pediatrico raro. Grazie alla consultazione di specialisti via l’ERN, questi bambini hanno ricevuto nuove terapie.
Nel 2017, all’ERN sulle epilessie rare e complesse è stato sottoposto il caso di un bambino finlandese di 4 anni con una anomalia cerebrale specifica causa di epilessia grave. Il suo medico in Finlandia ha consultato gli specialisti via l’ERN per richiedere consulenza sulla giusta terapia. Specialisti di almeno altri sei paesi hanno partecipato alla discussione e hanno condiviso conoscenze sulla terapia per il bambino.
In entrambi i casi, grazie all’ERN è stata fornita consulenza preziosa sulle cure per il paziente.
Il comitato di Stati membri per le ERN14 approva l’istituzione delle reti e l’adesione alle stesse. Alla fine del 2018, vi erano 952 prestatori di assistenza sanitaria (ad esempio, istituti, unità ospedaliere) in oltre 300 ospedali partecipanti alle ERN, diffusi in tutta l’UE. Nessuna ERN contava più di 19 Stati membri partecipanti. La figura 3 mostra che la distribuzione dei membri delle ERN prestatori di assistenza sanitaria varia da un paese all’altro nell’UE. In Italia si registra il più alto numero di prestatori di assistenza sanitaria che partecipano alle ERN. Questo Stato membro dispone da tempo di una strategia nazionale per le azioni in materia di malattie rare e una rete nazionale di ospedali specializzati e centri qualificati nell’assistenza a pazienti affetti da malattie rare.
Figura 3
Distribuzione dei membri delle ERN prestatori di assistenza sanitaria nell’UE

Fonte: Corte dei conti europea, sulla base dei dati dei prestatori di assistenza sanitaria membri della Rete europea di riferimento per lo Stato membro fornite dalla Commissione, febbraio 2019.
Estensione e approccio dell’audit
17Uno degli obiettivi strategici della Corte dei conti europea (nel prosieguo “la Corte”) è esaminare la performance in settori in cui l’azione dell’UE è importante per i cittadini15. Migliorare l’infrastruttura e i servizi sanitari dell’Europa e la loro accessibilità ed efficacia è un ambito in cui l’intervento dell’UE può fornire valore aggiunto ai cittadini dell’UE. La Corte ha iniziato il proprio audit 10 anni dopo che la Commissione aveva approvato la strategia sulle malattie rare e dopo l’avvio del principale progetto pilota dell’UE per gli scambi transfrontalieri di dati sanitari. L’audit intendeva rispondere al seguente quesito:
Le azioni dell’UE nel settore dell’assistenza sanitaria transfrontaliera apportano benefici ai pazienti?
18La Corte ha verificato se:
- la Commissione abbia vigilato in maniera adeguata sull’attuazione della direttiva UE sull’assistenza sanitaria transfrontaliera negli Stati membri;
- i risultati finora raggiunti per quanto riguarda gli scambi transfrontalieri di dati sanitari siano in linea con le aspettative;
- le azioni dell’UE riguardanti le malattie rare forniscano valore aggiunto agli sforzi compiuti dagli Stati membri per facilitare l’accesso dei pazienti all’assistenza sanitaria transfrontaliera.
L’audit ha riguardato il periodo che inizia con l’adozione della strategia della Commissione sulle malattie rare e l’avvio del principale progetto pilota dell’UE per gli scambi transfrontalieri di dati sanitari nel 2008. Il lavoro di audit è stato svolto tra febbraio e novembre 2018 e sono stati tenuti colloqui con rappresentanti della direzione generale della Salute e della sicurezza alimentare (DG SANTE), la direzione generale delle Reti di comunicazione, contenuti e tecnologie (DG CNECT) e il Centro comune di ricerca (DG JRC), nonché con le autorità responsabili dell’attuazione della direttiva di cinque Stati membri16. Gli Stati esaminati sono stati scelti tenendo conto dei principali progetti finanziati dall’UE riguardanti gli scambi transfrontalieri di dati sanitari.
20È stata inoltre svolta una indagine presso i rappresentanti degli Stati membri che partecipano al Gruppo di esperti sull’assistenza sanitaria transfrontaliera, per conoscere la loro opinione sui principali sviluppi e sui problemi che ostacolano l’accesso dei pazienti all’assistenza sanitaria transfrontaliera, nonché presso i rappresentanti della rete eHealth, per conoscere la loro opinione sul lavoro svolto dalla Commissione riguardo allo scambio transfrontaliero dei dati dei pazienti. La Corte ha ricevuto 15 risposte dal Gruppo di esperti sull’assistenza sanitaria transfrontaliera e 10 dalla rete eHealth.
21La Corte ha sottoposto ad audit i progetti finanziati dall’UE che miravano a facilitare l’accesso all’assistenza sanitaria transfrontaliera, tra cui i progetti per lo scambio transfrontaliero di dati sanitari e quelli per lo sviluppo e la manutenzione della piattaforma europea per la registrazione delle malattie rare. La Corte ha organizzato un panel di esperti per ottenere un parere indipendente sulla politica dell’UE in materia di malattie rare e sulle Reti di riferimento europee.
Osservazioni
La Commissione ha fatto sì che venisse attuata la direttiva dell’UE sull’assistenza sanitaria transfrontaliera
22Per vigilare sull’attuazione della direttiva, la Commissione deve monitorarne il recepimento da parte degli Stati membri e imporne il rispetto attraverso controlli sulla completezza e sulla conformità. La Commissione deve inoltre riferire sull’applicazione della direttiva e orientare opportunamente i punti di contatto nazionali che hanno il compito di fornire ai pazienti le informazioni sull’assistenza sanitaria transfrontaliera.
La Commissione ha monitorato l’attuazione della direttiva e ne ha imposto il rispetto?
23Dopo il termine previsto per il recepimento della direttiva (25 ottobre 2013) e i controlli svolti dalla Commissione sulla completezza del recepimento da parte degli Stati membri, la Commissione ha aperto 26 procedure d’infrazione per tardiva o incompleta notifica delle misure di recepimento. La Commissione ha avviato inoltre 21 procedure d’infrazione per tardivo o incompleto recepimento della direttiva di esecuzione sul riconoscimento delle ricette mediche emesse in un altro Stato membro17. Dopo che tutti gli Stati membri hanno notificato integralmente le misure nazionali di recepimento, la Commissione ha chiuso queste procedure nel novembre 2017.
24La Commissione verifica la legislazione degli Stati membri per stabilire se questi abbiano correttamente recepito le disposizioni della direttiva. Per eseguire controlli mirati, la Commissione ha individuato quattro ambiti prioritari in cui i pazienti transnazionali incontrano ostacoli: i sistemi di rimborso, l’uso dell’autorizzazione preventiva, i requisiti amministrativi e la fissazione delle tariffe per i pazienti in entrata. In esito a tali controlli, la Commissione ha aperto 11 casi di infrazione di propria iniziativa, quattro dei quali sono stati chiusi nel novembre 2018, dopo che gli Stati membri avevano modificato le misure nazionali di recepimento.
25La Corte ritiene che i controlli della Commissione abbiano consentito di migliorare i sistemi e le pratiche adottate dagli Stati membri.
La Commissione ha redatto tempestivamente le relazioni sul funzionamento della direttiva
26La Commissione è tenuta a redigere una relazione ogni tre anni, a partire dal 2015, sul funzionamento della direttiva18. Queste relazioni devono contenere informazioni sui flussi di pazienti e sui costi derivanti dalla loro mobilità. Anche se la direttiva non impone agli Stati membri di raccogliere dati sui flussi di pazienti, specifica che essi devono fornire alla Commissione l’assistenza e tutte le informazioni disponibili per preparare le relazioni. Nel 2013, gli Stati membri hanno convenuto di fornire dati specifici alla Commissione su base annuale.
27La maggior parte degli Stati ha adottato tardivamente le misure nazionali di recepimento (cfr. paragrafo 23) ) ritardando così la trasmissione dei dati alla Commissione nel 2015. Nel 2017, 26 Stati membri li hanno trasmessi, ma sei di essi hanno fornito dati incompleti. Inoltre, i dati non erano confrontabili da un paese all’altro, dato che alcuni Stati membri avevano indicato tutti i rimborsi senza specificare se fossero stati concessi in virtù della direttiva o del regolamento sul coordinamento dei sistemi di sicurezza sociale. La Commissione ha riconosciuto la scarsa precisione dei dati inclusa nelle relazioni. Ad esempio, il quadro complessivo dei flussi di pazienti era incompleto. Dalla tabella 1 risulta che quattro Stati membri non avevano fornito i dati sui flussi di pazienti in uscita nel 2016.
28Nonostante queste carenze, la Commissione ha adempiuto ai propri obblighi informativi nei tempi stabiliti. Nel settembre 2018, ha adottato la relazione più recente e ha presentato un quadro complessivo dei flussi di pazienti e dell’impatto finanziario dell’assistenza sanitaria transfrontaliera fornita nell’ambito della direttiva.
La Commissione ha guidato i punti di contatto nazionali nel migliorare le informazioni sull’assistenza sanitaria transfrontaliera
29La Commissione sostiene e guida i punti di contatto nazionali in modo che questi possano fornire informazioni chiare e complete sui diritti dei pazienti in materia di assistenza sanitaria transfrontaliera. A tal fine, la Commissione ha pubblicato una serie di studi in materia19. Prima del termine ultimo per il recepimento della direttiva, nel 2013 la Commissione ha inviato una nota orientativa agli Stati membri sui percorsi di trattamento sanitario disponibili per i pazienti: la direttiva sull’assistenza sanitaria transfrontaliera e il regolamento UE sul coordinamento dei sistemi di sicurezza sociale.
30Tuttavia, meno della metà dei siti Internet dei punti di contatto nazionali spiegava la differenza tra i due percorsi che i pazienti possono seguire per ottenere assistenza sanitaria in altri paesi20. Nel marzo 2018, la Commissione ha voluto ovviare a questa possibile confusione tra i due atti normativi organizzando un workshop per accrescere le capacità dei PCN ed elaborando uno strumento pratico per aiutare i PCN a fornire informazioni ai pazienti. Dall’indagine della Corte risulta che le autorità competenti negli Stati membri hanno accolto favorevolmente gli strumenti pratici, ma che occorre fare di più per contribuire a spiegare ai pazienti la differenza.
31Un recente studio della Commissione21 rilevava che le informazioni fornite ai pazienti sui siti Internet dei PCN erano generalmente adeguate e conformi ai requisiti della direttiva, ma che i siti Internet avrebbero potuto fornire maggiori informazioni sui diritti dei pazienti in entrata e sui rimborsi delle spese per l’assistenza sanitaria transfrontaliera per i pazienti in uscita. In aggiunta, una relazione del Parlamento europeo sulla direttiva rilevava che “sui siti Internet dei PCN mancano informazioni approfondite sui diritti dei pazienti”22.
32La direttiva non impone ai PCN di includere nei rispettivi siti informazioni sulle reti di riferimento europee. La Corte ha rilevato che alcuni PCN forniscono tali informazioni e altri stanno valutando come farlo. I rappresentanti di Germania, Irlanda, Lituania e Regno Unito hanno già manifestato il loro interesse a collaborare con il comitato di Stati membri per l’ERN23. Gli esperti di malattie rare consultati dagli auditor della Corte ritenevano che i PCN dovrebbero fornire informazioni sulle reti.
Scambio transfrontaliero dei dati sanitari dei pazienti: al momento dell’audit, alle grandi aspettative non erano seguiti risultati adeguati
33Per creare meccanismi per lo scambio dei dati sanitari dei pazienti all’interno dell’UE occorre un preciso quadro strategico e di governance, sostenuto dagli Stati membri. Bisogna definire obiettivi chiari e monitorare la performance regolarmente. Prima di avviare progetti su larga scala, la Commissione dovrebbe valutare, con l’aiuto degli Stati membri, i volumi dei potenziali utenti. Occorre trarre insegnamenti da quanto appreso dai progetti pilota precedenti.
La strategia per l’eHealth del 2018 non includeva un piano per l’attuazione
34I piani d’azione della Commissione sull’eHealth definiscono il suo approccio all’assistenza sanitaria on-line, anche per quanto concerne gli scambi transfrontalieri di dati dei pazienti. Il piano d’azione attuale riguarda il periodo 2012‑2020. Nell’aprile 2018 la Commissione ha adottato una nuova strategia per l’ eHealth24, più ampia rispetto al piano d’azione attuale, che include, in particolare, la possibile espansione dello scambio transfrontaliero delle cartelle cliniche elettroniche.
35Nel 2014, la Commissione ha pubblicato una valutazione intermedia del piano d’azione sull’eHealth25. Anche se complessivamente positiva, la valutazione rilevava alcune debolezze e raccomandava alla Commissione di aggiornare il piano per includervi le questioni più pertinenti, fornire una chiara struttura di governance e creare un meccanismo di monitoraggio e coordinamento.
36La Commissione ha attuato la maggior parte delle azioni previste dal piano d’azione sull’eHealth. Non ha dato seguito alla raccomandazione della valutazione 2014 che prevedeva di aggiornare il piano d’azione né ha rivisto tale piano per rispecchiare la strategia per l’eHealth del 2018. Il piano pertanto non include questioni importanti, come l’introduzione del regolamento generale sulla protezione dei dati. Inoltre, la Commissione non ha definito le competenze per l’attuazione del piano.
37La strategia per l’eHealth del 2018 fa riferimento a nuove sfide, come l’introduzione del regolamento generale sulla protezione dei dati e le minacce informatiche. Tuttavia, tale strategia non includeva un piano per l’attuazione indicante i termini entro cui ottenere i risultati e le realizzazioni attesi, che illustri l’approccio della Commissione per l’attuazione della strategia per l’eHealth. Quando la Commissione ha lanciato la strategia per l’eHealth del 2018, l’unica valutazione del piano d’azione 2012‑2020 risaliva al 2014.
La Commissione ha sottovalutato le difficoltà connesse all’introduzione dell’infrastruttura UE per l’eHealth
38La Commissione ha lavorato sullo scambio dei dati dei pazienti tra Stati membri in due fasi: un progetto pilota (epSOS)26 dal 2008 al 2012, per un costo di 18 milioni di euro, e un progetto di applicazione (Infrastruttura UE per l’eHealth)27, con una dotazione di 35 milioni di euro, iniziato nel 2015.
39L’obiettivo dell’epSOS era di sviluppare un quadro e una infrastruttura di tecnologie dell’informazione e delle comunicazioni per consentire l’accesso transfrontaliero sicuro alle informazioni sanitarie dei pazienti. Il progetto pilota doveva verificare la fattibilità funzionale, tecnica e giuridica e l’accettazione della soluzione proposta per gli scambi transfrontalieri di dati sanitari. Esso mirava a dimostrare l’attuabilità pratica della soluzione in una serie di contesti e in una serie di Stati partecipanti.
40Il progetto elaborava le definizioni del contenuto informativo dei fascicoli dei pazienti e delle prescrizioni elettroniche (cfr. paragrafo 09), nonché i meccanismi per testare, rivedere ed approvare gli scambi transfrontalieri di dati. Esso ha contribuito allo sviluppo delle specifiche di interoperabilità e degli orientamenti per l’eHealth, ha fornito standard comuni per promuovere tali scambi e ha dimostrato l’impegno degli Stati membri a cooperare in questo ambito.
41In fase di pianificazione del progetto, non è stata stabilita l’estensione e la portata dei test necessari prima di passare all’attuazione pratica. La verifica della fattibilità della soluzione proposta ha riguardato 43 trasferimenti di dati di pazienti. Il progetto ha fornito quindi solo una dimostrazione pratica limitata della soluzione proposta. Nella valutazione finale del progetto, i valutatori esterni hanno concluso che il numero di fascicoli dei pazienti e delle prescrizioni elettroniche reali era troppo basso per poter considerare operativi e robusti i servizi epSOS28. Tuttavia, tale scambio, anche se limitato, è stato considerato dalla Commissione una sufficiente verifica del concetto dell’infrastruttura di servizi digitali per l’eHealth (eHDSI).
42La Commissione ha valutato il progetto epSOS nel 2014. Secondo la valutazione, sebbene le aspettative riguardo a numeri statisticamente significativi di scambi di dati non si fossero fino ad allora realizzate nel progetto epSOS, era stata dimostrata la validità del concetto alla base dell’approccio epSOS di interoperabilità transfrontaliera29. Inoltre, i problemi di interoperabilità a livello giuridico, organizzativo e semantico si erano rivelati più complessi del previsto. La Commissione aveva anche individuato dichiarazioni di spese non ammissibili da parte dei contraenti del progetto, per lo più connessi alle spese per il personale. Al momento dell’audit, la Commissione stava recuperando le spese non ammissibili, pari al 42 % dei finanziamenti forniti.
43Nonostante tali difficoltà, nel 2015 la Commissione ha deciso di utilizzare le realizzazioni del progetto pilota come base per lo sviluppo dell’infrastruttura di servizi digitali per l’eHealth (eHDSI). L’architettura, le specifiche tecniche e semantiche dell’eHDSI, gli accordi giuridici, organizzativi e strategici tra gli Stati membri partecipanti sono basati su quanto prodotto dal progetto epSOS.
44La Corte ha individuato debolezze nelle modalità con cui la Commissione ha preparato questo complesso progetto, in particolare la stima insufficiente dei volumi di potenziali utenti (pazienti e prestatori di assistenza sanitaria, come farmacie ed ospedali) dei servizi transfrontalieri di eHealth forniti dall’eHDSI e l’insufficiente valutazione del rapporto costi/benefici di questi servizi prima del lancio dell’eHDSI. Pertanto, a giudizio della Corte, la Commissione ha sottovalutato le difficoltà connesse all’introduzione dell’infrastruttura UE per l’eHealth.
La Commissione ha sovrastimato la probabile diffusione dell’infrastruttura di servizi digitali per l’eHealth
45Gli annunci della Commissione sul probabile livello di scambi transfrontalieri di dati sanitari sono stati eccessivamente ottimisti (cfr. riquadro 3).
Riquadro 3
Annunci della Commissione sull’introduzione dell’infrastruttura UE per l’eHealth
Nel dicembre 2017, la Commissione ha annunciato che nel 2018, 12 Stati membri dell’UE avrebbero iniziato a scambiarsi dati dei pazienti su base regolare30.
Sul proprio sito sulla governance dell’infrastruttura per l’eHealth, la Commissione dichiarava che nel 2019 lo scambio transfrontaliero di dati sanitari nell’UE avrebbe presumibilmente iniziato ad essere una pratica accettata dai sistemi sanitari nazionali31.
Nel valutare la propria performance, la Commissione indicava che, nel 2017, dieci Stati membri avevano la capacità per scambiare dati sanitari e partecipare ai servizi informativi transfrontalieri per l’eHealth32. Questo dato era basato sulle dichiarazioni degli Stati membri riguardo ai portali nazionali per l’eHealth e includeva gli Stati membri che avevano solo iniziato a creare i propri portali, ma non avevano confermato di essere pronti per lo scambio transfrontaliero di dati sanitari.
Al momento dell’audit della Corte (novembre 2018), non erano ancora iniziati gli scambi transfrontalieri di dati sanitari dei pazienti attraverso l’infrastruttura UE per l’eHealth (cfr. allegato II, che mostra le date di attivazione degli scambi transfrontalieri di dati sanitari negli Stati membri). In quel momento, la Commissione aveva valutato la capacità di sette Stati membri33 di attivare gli scambi transfrontalieri. Quattro di questi (Cechia, Estonia, Lussemburgo e Finlandia) avevano effettuato verifiche di follow-up. Nell’ottobre 2018, l’eHMSEG raccomandava loro di attivare gli scambi, a condizione che fossero state adottate tutte le misure correttive. La figura 4 illustra la procedura con cui gli Stati membri aderiscono al Servizio informativo transfrontaliero e la situazione al 2018.
Figura 4
La procedura per aderire ai servizi informativi transfrontalieri per l’eHealth – situazione 2018

Fonte: Corte dei conti europea, sulla base delle informazioni fornite dalla Commissione.
La Corte ha anche rilevato che questi quattro Stati membri erano stati ammessi all’Infrastruttura UE per l’eHealth per utilizzare diversi tipi di servizi di eHealth. Al momento dell’audit, la Finlandia era pronta ad inviare le prescrizioni elettroniche, mentre l’Estonia poteva riceverle (agli inizi del 2019 questo era l’unico scambio di prescrizioni elettroniche disponibile in Europa). Secondo la Commissione, 550 prescrizioni elettroniche erano state così liquidate tra gennaio e la fine di febbraio 2019. La Cechia e il Lussemburgo erano pronti a ricevere i fascicoli elettronici dei pazienti dall’estero, ma nessuno Stato membro poteva ancora trasmetterli via eHDSI. Inoltre, all’inizio solo alcuni prestatori nazionali di assistenza sanitaria e alcune farmacie in questi paesi utilizzeranno il sistema. Il riquadro 4 illustra i benefici che i pazienti possono trarre dagli scambi transfrontalieri di prescrizioni elettroniche e di fascicoli elettronici dei pazienti.
Riquadro 4
Scambi transfrontalieri
Prescrizioni elettroniche (il caso di Finlandia ed Estonia)
Quando un paziente con una prescrizione elettronica emessa in Finlandia si reca in una farmacia estone per acquistare una medicina, la farmacia registra il codice identificativo del paziente. La farmacia trasmette poi i dati della prescrizione, a condizione che vi sia il consenso del paziente, al portale estone per l’eHealth (NCPeH), che li trasmette al portale finlandese per l’eHealth. Dopo che la farmacia estone ha fornito la medicina al paziente, il portale finlandese per l’eHealth viene informato che la prescrizione elettronica è stata trattata (cfr. figura 1).
Fascicoli elettronici dei pazienti
Quando una persona ha una emergenza medica o effettua una visita non programmata presso un prestatore di assistenza sanitaria estero, il personale medico può avere accesso elettronicamente alle informazioni mediche del paziente nel paese di affiliazione di quest’ultimo attraverso il portale UE per l’eHealth. Il fascicolo del paziente potrebbe includere informazioni sulle allergie del paziente a farmaci e può facilitare la diagnosi del caso del paziente all’estero.
Le reti di riferimento europee per le malattie rare sono una innovazione ambiziosa, ma la loro sostenibilità resta da dimostrare
48Affinché la Commissione possa sostenere efficacemente gli Stati membri nello sviluppo delle reti di riferimento europee, tale sostegno deve essere fornito nel contesto di un quadro giuridico, sulla base di una strategia coerente e con una tabella di marcia chiara.
La Commissione non ha aggiornato il proprio quadro per le azioni UE nel campo delle malattie rare
49Lo sviluppo delle reti di riferimento europee è parte di una politica dell’UE più ampia nel campo delle malattie rare, che include elementi quali il sostegno all’elaborazione di piani nazionali per le malattie rare, una migliore standardizzazione della nomenclatura delle malattie rare e il sostegno alla ricerca su tali malattie. La comunicazione della Commissione del 2008 sulle malattie rare mirava ad “incoraggiare la cooperazione tra gli Stati membri e, ove necessario, appoggiare la loro azione”. L’obiettivo era di “definire una strategia comunitaria globale”34 per aiutare l’azione degli Stati membri nel campo delle malattie rare. Il Consiglio ha sostenuto tale approccio nella sua raccomandazione su un’azione nel settore delle malattie rare dell’8 giugno 200935.
50Nel 2014 la Commissione ha pubblicato una relazione sull’attuazione sia della comunicazione che della raccomandazione del Consiglio. Questa relazione conclude che gli obiettivi della comunicazione e della raccomandazione del Consiglio sono stati in gran parte raggiunti. Tali obiettivi includevano l’introduzione di una definizione chiara delle malattie rare o una migliore codificazione di tali malattie nei sistemi sanitari. La relazione riconosce che ancora molto resta da fare per far sì che i pazienti affetti da malattie rare nell’UE ricevano l’assistenza di cui necessitano e sottolinea che la mancanza di strategie per le malattie rare in alcuni Stati membri richiede ulteriore impegno. Elenca 11 azioni contemplate dalla Commissione, tra cui il continuo sostegno alla piattaforma europea per le malattie rare e per lo sviluppo di piani per le stesse.
51Nonostante la relazione concluda che gli obiettivi sono stati raggiunti, nove delle 11 azioni previste erano la continuazione di iniziative preesistenti. La Commissione non ha aggiornato la strategia per le malattie rare dal 2008, anche se gestisce importanti iniziative come le reti di riferimento europee e la piattaforma UE per i registri delle malattie rare.
La Commissione non ha applicato quanto appreso dai progetti pilota per le reti di riferimento europee
52La Commissione ha finanziato dieci reti di riferimento pilota tra il 2007 e il 2013. Il comitato consultivo della Commissione sulle malattie rare (EUCERD)36 ha valutato queste ERN pilota ed ha pubblicato un’analisi preliminare degli effetti e delle esperienze delle reti di riferimento europee per le malattie rare nel 2011. Tuttavia, quando la Commissione ha istituito le ERN, queste affrontavano solo alcune delle questioni sollevate nella valutazione del 2001, ad esempio il sostegno ai registri dei pazienti, la necessità di uno strumento dedicato di tecnologie dell’informazione e della comunicazione e la necessità che ogni membro della rete disponesse di procedure per il controllo della qualità delle pratiche terapeutiche. Tra le questioni ancora in sospeso vi sono:
- la sostenibilità delle reti al di là del periodo iniziale di finanziamento;
- lo sviluppo di un sistema per un monitoraggio e un controllo di qualità costanti per i membri della rete;
- i problemi amministrativi e i costi finanziari connessi all’espansione di una rete e
- la sostenibilità del sostegno ai registri dei pazienti.
Sin dalla sua istituzione nel 2014, il comitato di Stati membri per le reti ha continuato a lavorare su questi punti in sospeso. Ha realizzato progressi per quanto riguarda il monitoraggio e il controllo di qualità costante (per il quale nel settembre 2018 ha approvato una serie di indicatori chiave raccolti dalle ERN). Sono emerse però questioni nuove, come l’integrazione delle reti nei sistemi sanitari nazionali e la collaborazione con l’industria, che devono ancora trovare soluzione. La figura 5 illustra le diverse sfide che le reti si trovano ad affrontare, a cui la Commissione, il comitato di Stati membri o i gruppi di coordinatori delle reti stanno attualmente lavorando.
Figura 5
Sfide per lo sviluppo delle reti di riferimento europee

Fonte: Corte dei conti europea, sulla base dei verbali del comitato di Stati membri per le reti di riferimento europee.
La Commissione ha sostenuto la costituzione di 24 reti di riferimento europee, ma non ha creato un efficace sistema per valutare i partecipanti
54La direttiva dava incarico alla Commissione di definire criteri e condizioni specifiche che i prestatori di assistenza sanitaria devono soddisfare per aderire ad una ERN37. La Commissione ha incaricato un consulente di elaborare un insieme di orientamenti per i richiedenti e per l’organismo di valutazione indipendente (IAB) che ha valutato le ERN e le singole domande dei prestatori di assistenza sanitaria. La Commissione si è sforzata di sensibilizzare le parti interessate sull’avvio delle ERN e ha superato l’obiettivo iniziale di fornire sostegno per la creazione di dieci ERN38 (ne ha create 24) (cfr. allegato III per l’elenco delle reti di riferimento europee).
55La figura 6 illustra la procedura di valutazione delle domande di adesione alle ERN dei prestatori di assistenza sanitaria. Prima di presentare una domanda, ogni prestatore di assistenza sanitaria doveva prima essere approvato dall’autorità competente dello Stato membro. La procedura di valutazione a livello UE era limitata alla verifica dell’ammissibilità delle domande e alla valutazione di un campione del 20 % delle domande individuali.
Figura 6
Albero decisionale del processo di verifica e valutazione dell’ammissibilità delle domande di adesione alle reti di riferimento europee presentate da un prestatore di assistenza sanitaria (HCP)

Fonte: Analisi della Corte dei conti europea, sulla base dei documenti forniti dall’Agenzia esecutiva per i consumatori, la salute, l’agricoltura e la sicurezza alimentare.
L’organismo di valutazione indipendente ha prodotto 62 relazioni preliminari negative. In tutti questi casi, i richiedenti avevano fornito informazioni39 sui punti in sospeso, che hanno consentito all’organismo di valutazione di esprimere un parere positivo. Tuttavia, l’esame di un campione40 di relazioni di valutazione eseguito dalla Corte ha rivelato che in molti casi l’organismo di valutazione aveva espresso un giudizio finale positivo sulla base di informazioni incomplete. L’esito finale della procedura di valutazione è stato che 952 prestatori di assistenza sanitaria, su 953 che avevano presentato domanda, sono stati accettati nelle ERN. La Corte conclude che, nella pratica, questo processo di valutazione ha fornito un valore aggiunto limitato per la costituzione delle ERN.
57Il sistema di valutazione a campione non era in origine affiancato da altre misure di monitoraggio o valutazione. Dal dicembre 2016, la Commissione collabora con i rappresentanti degli Stati membri e con i coordinatori delle ERN per elaborare un sistema di monitoraggio costante da parte della Commissione e di autovalutazione periodica di tutti i membri delle ERN. Tuttavia, al momento dell’audit, non avevano deciso quali misure adottare nel caso questo sistema di monitoraggio individui prestatori di assistenza sanitaria inadeguati. La Commissione ha inoltre in programma di valutare le ERN alla fine del periodo di finanziamento quinquennale41.
Il bilancio UE non contiene una linea specifica per i costi delle reti di riferimento europee
58La direttiva richiedeva alla Commissione di sostenere gli Stati membri nello sviluppo delle ERN. Il bilancio UE non contiene una linea specifica per i costi delle ERN. La Commissione, per sostenere il funzionamento delle ERN, ha fornito finanziamenti provenienti da diversi programmi di spesa (programma Salute, meccanismo per collegare l’Europa) e attraverso diversi meccanismi di spesa (inviti a presentare proposte e gare di appalto). La Commissione non ha provveduto a elaborare un piano di spesa completo per il periodo 2017‑2021 e a comunicarlo alle ERN e all’autorità di bilancio.
59Nel novembre 2017, la Commissione ha fornito alle reti il Sistema di gestione clinica del paziente (CPMS) per condividere e consultare i dati dei pazienti (cfr. paragrafo 15). La possibilità di consultare i dati dei pazienti utilizzando questo sistema è uno dei progressi significativi consentiti dal funzionamento delle ERN. Tuttavia, il ricorso alle consultazioni transfrontaliere attraverso il Sistema di gestione clinica del paziente (CPMS) ha evidenziato il problema del riconoscimento del tempo dedicato dai medici alla diagnosi e alla cura di pazienti di un altro Stato membro. La figura 7 mostra il numero dei panel di consultazione creati nel sistema per le ERN tra novembre 2017 e dicembre 2018.
Figura 7
I panel di consultazione sono un indicatore del funzionamento delle ERN

Fonte: Relazione sul Sistema di gestione clinica del paziente (CPMS) della Commissione 12.2018
Ogni coordinatore ERN riceve 1 milione di euro di finanziamenti UE42 per 5 anni per coprire i costi amministrativi. Vi sono stati spesso ritardi nel versamento dei contributi annuali per le spese amministrative delle ERN. Una indagine della Commissione presso i coordinatori delle ERN del gennaio 2018, a cui avevano risposto 20 ERN, aveva mostrato che la sostenibilità dei finanziamenti è uno dei principali problemi delle ERN43. 17 delle 24 ERN avevano incluso l’individuazione di altre fonti di finanziamento tra i propri obiettivi o nelle loro strategie di riduzione dei rischi.
61Oltre a questi finanziamenti per le spese amministrative, la Commissione aveva versato alle ERN sovvenzioni per sostenerle nel conseguimento dei loro obiettivi. Ha indetto procedure d’appalto per sviluppare le attività di supporto per la costituzione e lo sviluppo delle reti. Alla fine del 2018, queste includevano:
- l’uso di soluzioni di eHealth, come il Sistema di gestione clinica del paziente (5 milioni di euro assegnati dal fondo del meccanismo per collegare l’Europa);
- l’elaborazione di linee guida per la pratica clinica (in totale 4 milioni di euro dal programma Salute);
- i registri delle ERN (in totale 2 milioni di euro per cinque ERN nel 2008, dal programma Salute);
- formazione e strumenti per i coordinatori delle ERN (bando per società esterne, valore stimato: 400 000 euro);
- sostegno per il lavoro di segreteria per il gruppo di lavoro dei coordinatori delle ERN (bando per società esterne, valore stimato: 380 000 euro);
- elaborazione di modelli di documenti per le ERN (bando per società esterne, valore stimato: 100 000 euro).
I coordinatori delle ERN ritengono che rispondere agli inviti a presentare proposte diffusi dalla Commissione aveva richiesto un notevole impegno amministrativo. Inoltre, la sostenibilità a lungo termine dei registri delle ERN, attualmente finanziata dei fondi del programma Salute, è incerta nonostante la Commissione abbia sottolineato il rischio di finanziare singoli progetti per i registri nella sua comunicazione del 2008 sulle malattie rare.
Nonostante i ritardi, la Commissione sta lanciando una piattaforma per i registri delle malattie rare a livello UE
63Nella comunicazione del 2008 sulle malattie rare, la Commissione sottolineava l’importanza dei registri e delle basi di dati per la ricerca epidemiologica e clinica sulle malattie rare. Sottolineava inoltre l’importanza di garantire la durata a lungo termine di tali sistemi. In risposta a tale sfida, nel 2013 il JRC ha iniziato a sviluppare la piattaforma europea per la registrazione delle malattie rare, cofinanziata dal programma Salute44 e aperta a tutti i registri europei di malattie rare. La piattaforma del JRC mira a porre rimedio alla frammentazione dei dati contenuti nei registri dei pazienti affetti da malattie rare in tutta Europa, promuovendo standard a livello UE per la raccolta dati e fornendo strumenti di interoperabilità per gli scambi di dati sulle malattie rare.
64La Corte ha riscontrato che, parallelamente alla piattaforma del JRC, la Commissione aveva finanziato un altro progetto, RD Connect, attraverso il programma di finanziamento della ricerca e dell’innovazione (settimo programma quadro), che mirava, tra l’altro alla creazione di una base dati dei registri dei pazienti per la ricerca sulle malattie rare. I due progetti hanno un obiettivo simile: collegare i registri nell’UE per facilitare l’accesso dei ricercatori ai dati sulle malattie rare. La Commissione sta quindi finanziando due progetti che potrebbero approdare a risultati sovrapponibili.
65Al momento dell’audit, la piattaforma del JRC avrebbe dovuto entrare in funzione nel febbraio 2019, con oltre due anni di ritardo rispetto a quanto inizialmente previsto. Una delle ragioni di tale ritardo era legata al fatto che lo sviluppo della piattaforma del JRC includeva anche il trasferimento di due reti esistenti45 al JRC, che ha richiesto più tempo e risorse di quanto preventivato. La Corte ha rilevato che la tempistica e la dotazione finanziaria originariamente definita per la piattaforma erano irrealistiche. Inoltre, il finanziamento della DG SANTE destinato alla piattaforma del JRC copre attualmente circa il 45 % dei costi del lavoro, ma non vi sono disposizioni riguardo alla sostenibilità finanziaria della piattaforma o una pianificazione che ne garantisca la riuscita, a parte un piano di divulgazione redatto nel quarto trimestre 2017.
Conclusioni e raccomandazioni
66La Corte ha esaminato la sorveglianza esercitata dalla Commissione sul recepimento della direttiva sull’assistenza sanitaria transfrontaliera negli Stati membri e i risultati conseguiti finora per quanto riguarda gli scambi transfrontalieri di dati sanitari. Ha valutato inoltre le azioni intraprese dall’UE nel campo della politica sulle malattie rare. La Corte intendeva rispondere al seguente quesito:
Le azioni dell’UE nel settore dell’assistenza sanitaria transfrontaliera apportano benefici ai pazienti?
67La Corte ha concluso che le azioni intraprese dall’UE nel settore dell’assistenza sanitaria transfrontaliera erano ambiziose e hanno accresciuto la collaborazione tra gli Stati membri, ma devono essere gestite meglio. Stando a quanto constatato al momento dell’audit, l’impatto sui pazienti era limitato.
68La Corte ha rilevato che la Commissione ha vigilato adeguatamente sull’attuazione della direttiva negli Stati membri (paragrafi 23 - 28), ed ha sostenuto il lavoro dei punti di contatto nazionali responsabili di informare i pazienti riguardo ai loro diritti in materia di assistenza sanitaria transfrontaliera. Recentemente ha messo a punto uno strumento pratico per i PCN. Tuttavia, i pazienti dell’UE hanno ancora difficoltà ad accedere all’assistenza sanitaria all’estero e solo una minoranza dei potenziali pazienti sa di aver diritto a beneficiare dell’assistenza sanitaria transfrontaliera. La complessità dei percorsi per l’assistenza sanitaria transfrontaliera che i pazienti possono seguire nel quadro della direttiva sull’assistenza sanitaria transfrontaliera e del regolamento sul coordinamento in materia di sicurezza sociale rendono difficile fornire ai pazienti informazioni chiare. I siti dei PCN forniscono informazioni limitate sulle ERN (paragrafi 29 - 32).
Raccomandazione 1 – Fornire maggiore sostegno ai punti di contatto nazionaliLa Commissione dovrebbe:
- continuando le azioni precedentemente intraprese, sostenere il lavoro dei punti di contatto nazionali, in particolare su come spiegare meglio il rapporto tra i percorsi forniti dalla direttiva sull’assistenza sanitaria transfrontaliera e quelli previsti dal regolamento sul coordinamento in materia di sicurezza sociale;
- emanare linee guida su come presentare le informazioni sulle reti di riferimento europee sui siti Internet dei punti di contatto nazionali;
- seguire l’uso, da parte dei punti di contatto nazionali, dello strumento del 2018.
Data-obiettivo di attuazione: 2020
69Nel 2018, la Commissione ha adottato una nuova strategia in materia di assistenza sanitaria on-line (eHealth) senza aggiornare il piano d’azione per l’eHealth esistente. La strategia per l’eHealth del 2018 non contiene un piano d’attuazione che definisca i tempi entro cui raggiungere i risultati e le realizzazioni attese (paragrafi 34 - 37).
70Il lavoro sugli scambi transfrontalieri di dati sanitari ha portato alla definizione di standard di interoperabilità. La Commissione, in cooperazione con gli Stati membri, sta costruendo una infrastruttura a livello UE per questi scambi. La Commissione non ha stimato il numero di potenziali utenti dell’infrastruttura UE per l’eHealth prima di avviare il progetto. Le previsioni della Commissione riguardo alla probabile diffusione degli scambi transfrontalieri di dati sanitari erano eccessivamente ottimistiche. Vi sono stati ritardi nell’introduzione dell’infrastruttura per l’eHealth e, al momento dell’audit, gli scambi transfrontalieri di dati sanitari attraverso tale infrastruttura non erano ancora iniziati (paragrafi 38 - 47).
Raccomandazione 2 – Preparare meglio gli scambi transfrontalieri di dati sanitariLa Commissione dovrebbe:
- valutare i risultati ottenuti negli scambi transfrontalieri di dati sanitari attraverso l’infrastruttura UE per l’eHealth (per le prescrizioni elettroniche e i fascicoli elettronici dei pazienti);
- su tale base, valutare il piano d’azione per l’eHealth del 2012 e l’attuazione della strategia per l’eHealth del 2018, esaminando tra l’altro se le azioni abbiano fornito soluzioni tempestive e con un buon rapporto costi/benefici nonché un contributo significativo ai sistemi nazionali di assistenza sanitaria.
Data-obiettivo di attuazione: 2021
Data-obiettivo di attuazione: 2021
L’avvio delle reti di riferimento europee rappresenta una innovazione ambiziosa per la cooperazione nel campo dell’assistenza sanitaria transfrontaliera, soprattutto perché l’assistenza sanitaria è competenza degli Stati membri. La Commissione ha fornito alle ERN il Sistema di gestione clinica del paziente per facilitare la condivisione dei dati sanitari dei pazienti. Le ERN sono state costituite nel marzo 2017 ed è troppo presto per valutarne il successo in termini di valore aggiunto rispetto a quanto realizzato dagli Stati membri per fornire migliore assistenza ai pazienti affetti da malattie rare.
72La Corte ha riscontrato che la Commissione non ha tenuto conto dei progressi compiuti nell’attuazione della strategia UE sulle malattie rare dal 2014 (paragrafi 49 - 51). Il processo per la costituzione delle ERN e il sostegno continuo ad esse fornito dalla Commissione sono stati inficiati da carenze e la Commissione non ha elaborato un piano di spesa per le ERN. Le ERN hanno notevoli difficoltà ad assicurare la propria sostenibilità finanziaria e ad operare efficacemente all’interno dei sistemi sanitari nazionali e nei rapporti tra questi. La Commissione ha quindi incoraggiato gli Stati membri ad integrare le ERN nei sistemi sanitari nazionali (paragrafi 52 - 62). La Corte ha riscontrato inoltre che vi sono stati ritardi nell’avvio della piattaforma UE per i registri delle malattie rare (paragrafi 63 - 65).
Raccomandazione 3 - Migliorare il sostegno per facilitare l’accesso all’assistenza sanitaria per i pazienti affetti da malattie rareLa Commissione dovrebbe:
- valutare i risultati della strategia UE sulle malattie rare (compreso il ruolo delle reti di riferimento europee) e decidere se questa strategia debba essere aggiornata, adattata o sostituita;
- in consultazione con gli Stati membri, stabilire l’approccio per continuare ad affrontare le sfide incontrate dalle reti di riferimento europee (tra cui l’integrazione delle reti di riferimento europee nei sistemi sanitari nazionali e i registri dei pazienti);
- mirare a semplificare la struttura per il futuro finanziamento UE delle reti di riferimento europee e ridurre l’onere amministrativo che grava su di esse.
Data-obiettivo di attuazione: 2023
Data-obiettivo di attuazione: 2020
Data-obiettivo di attuazione: 2022
La presente relazione è stata adottata dalla Sezione I, presieduta da Nikolaos MILIONIS, Membro della Corte dei conti europea, a Lussemburgo, nella riunione del 10 aprile 2019.
Per la Corte dei conti europea

Klaus-Heiner LEHNE
Presidente
Allegati
Allegato I – Confronto tra i diritti dei pazienti in materia di assistenza sanitaria transfrontaliera nel quadro della direttiva e del regolamento
| DIRETTIVA | REGOLAMENTO | |
|---|---|---|
| Settore | Pubblico + Privato | Solo Pubblico |
| Cure ammissibili | Cure disponibili nel quadro dell’assistenza sanitaria del paese di affiliazione del paziente | Cure disponibili nel quadro dell’assistenza sanitaria nazionale dell’altro paese |
| Autorizzazione preventiva | Richiesta in talune circostanze | Sempre richiesta per cure programmate Non richiesta per situazioni d’emergenza |
| Costi coperti | Rimborso fino all’importo che sarebbe stato coperto nel paese di affiliazione | Finanziamento completo (escluso ticket sanitario) |
| Rimborso del ticket sanitario | Fino al limite del costo nel paese di affiliazione | Si (a determinate condizioni) |
| Metodo di pagamento | Anticipo delle spese da parte del paziente e successivo rimborso delle spese (sistema a rimborso) | Tra paesi, non è richiesto alcun anticipo da parte del paziente (sistema a finanziamento) |
| Paesi ammissibili | Tutti i paesi dell’UE e del SEE | Tutti i paesi dell’UE e del SEE + Svizzera |
Fonte: Corte dei conti europea sulla base del sito “Healthcare beyond borders’.
Allegato II – Situazione attuale per l’introduzione degli scambi transfrontalieri di dati sanitari nell’UE

Fonte:: Service Catalogue, Delivery and Overall Deployment – eHDSI – ePrescription and Patient Summary, disponibile sul sito dell’eHDSI46.
Allegato III – Elenco delle reti di riferimento europee
| Abbreviazione ERN | Denominazione completa ERN |
|---|---|
| Endo-ERN | Rete di riferimento europea sulle condizioni endocrine |
| ERKNet | Rete di riferimento europea sulle malattie renali |
| ERN BOND | Rete di riferimento europea sui disturbi ossei rari |
| ERN CRANIO | Rete di riferimento europea sulle anomalie craniofacciali e i disturbi otorinolaringoiatrici |
| EpiCARE | Rete di riferimento europea sulle epilessie rare e complesse |
| ERN EURACAN | Rete di riferimento europea sui tumori degli adulti (tumori solidi) |
| EuroBloodNet | Rete di riferimento europea sulle malattie ematologiche |
| ERN eUROGEN | Rete di riferimento europea sulle malattie e le condizioni urogenitali |
| ERN EURO-NMD | Rete di riferimento europea sulle malattie neuromuscolari |
| ERN EYE | Rete di riferimento europea sulle malattie oculistiche |
| ERN Genturis | Rete di riferimento europea sulle sindromi da rischio di tumore ereditario |
| ERN GUARD-Heart | Rete di riferimento europea sulle malattie cardiache complesse rare e a bassa prevalenza |
| ERN ERNICA | Rete di riferimento europea sulle anomalie congenite ed ereditarie |
| ERN ITHACA | Rete di riferimento europea sulle malformazioni congenite e le disabilità intellettuali |
| ERN LUNG | Rete di riferimento europea sulle malattie respiratorie |
| ERN TRANSPLANT-CHILD | Rete di riferimento europea sui trapianti nei bambini |
| ERN PaedCan | Rete di riferimento europea sui tumori pediatrici (ematooncologia) |
| ERN RARE-LIVER | Rete di riferimento europea sulle malattie epatiche |
| ERN ReCONNET | Rete di riferimento europea sulle malattie muscoloscheletriche e del tessuto connettivo |
| ERN RITA | Rete di riferimento europea sull’immunodeficienza e le malattie autoinfiammatorie e autoimmuni |
| ERN-RND | Rete di riferimento europea sulle malattie neurologiche |
| ERN Skin | Rete di riferimento europea sui disturbi dermatologici |
| MetabERN | Rete di riferimento europea sui disturbi ereditari del metabolismo |
| VASCERN | Rete di riferimento europea sulle malattie vascolari multisistemiche rare |
Acronimi e abbreviazioni
CPMS: Sistema di gestione clinica del paziente
DG SANTE: Direzione generale della Salute e della sicurezza alimentare
eHDSI: Infrastruttura di servizi digitali per l’eHealth
eHMSEG: Gruppo di esperti degli Stati membri per l’eHDSI
epSOS: Smart Open Service for European Patients
ERN: Rete di riferimento europea
EUCERD: Comitato di esperti dell’Unione europea sulle malattie rare
HCP: Prestatori di assistenza sanitaria
IAB: Organismo di valutazione indipendente
JRC: direzione generale Centro comune di ricerca della Commissione europea
MCE: Meccanismo per collegare l’Europa
MR: Malattia rara
NCPeH: Punto di contatto nazionale per l’eHealth
PCN: Punto di contatto nazionale
RAA: Relazione annuale di attività
TFUE: trattato sul funzionamento dell’Unione europea
Glossario
Assistenza sanitaria transfrontaliera: assistenza sanitaria fornita o prescritta al di fuori del paese di affiliazione dell’assicurato.
Cartella clinica elettronica: una documentazione medica completa o documentazione analoga sullo stato di salute fisico e mentale, passato e presente di un individuo in forma elettronica, che consenta la pronta disponibilità di tali dati per cure mediche e altri fini strettamente collegati.
Coordinatore ERN: per ciascuna rete un membro fungerà da coordinatore e faciliterà la cooperazione tra i membri della rete.
eHealth – assistenza sanitaria on-line: uso delle tecnologie dell’informazione e della comunicazione in prodotti, servizi e processi sanitari, combinato con cambiamenti organizzativi dei sistemi sanitari e nuove competenze. L’eHealth è il trasferimento dell’assistenza sanitaria per via elettronica.
Interoperabilità: capacità di utilizzare e scambiare dati tra diversi sistemi sanitari per collegare le informazioni.
Malattia rara: nell’UE si definiscono rare le malattie o i disturbi che interessano meno di 5 persone su 10 000.
Prescrizione elettronica: una prescrizione per medicine o trattamenti, fornita in formato elettronico con l’uso di software da un professionista del settore sanitario legalmente autorizzato e trasmissione elettronica dei dati di una prescrizione ad una farmacia in cui le medicine possono essere fornite.
Reti di riferimento europee (ERN): reti virtuali che riuniscono i prestatori di assistenza sanitaria di tutta Europa. Esse mirano ad affrontare casi di malattie rare o complesse e condizioni che richiedono cure altamente specializzate e la concentrazione di risorse e conoscenze.
Note
1 Direttiva 2011/24/UE del Parlamento europeo e del Consiglio, del 9 marzo 2011, concernente l’applicazione dei diritti dei pazienti relativi all’assistenza sanitaria transfrontaliera (GU L 88 del 4.4.2011, pag. 45).
2 Articolo 168 del Trattato sul funzionamento dell’Unione europea (TFUE).
3 Regolamento (CE) n. 883/2004 del Parlamento europeo e del Consiglio, del 29 aprile 2004, relativo al coordinamento dei sistemi di sicurezza sociale (GU L 166 del 30.4.2004, pag. 1). Il regolamento si applica all’assistenza sanitaria transfrontaliera nel contesto della mobilità per motivi di lavoro o turismo e i relativi collegamenti tra assistenza sanitaria e sistemi di sicurezza sociale.
4 In base ai risultati di una indagine dei PCN condotta dal Gruppo di esperti sull’assistenza sanitaria transfrontaliera nel maggio 2017 e confermato dall’indagine condotta dalla Corte presso i membri del Gruppo di esperti sull’assistenza sanitaria transfrontaliera.
5 Relazione della Commissione sul funzionamento della direttiva 2011/24/UE concernente l’applicazione dei diritti dei pazienti relativi all’assistenza sanitaria transfrontaliera”, COM(2018) 651 final.
6 Allegato B della Relazione della Commissione sul funzionamento della direttiva 2011/24/UE, COM(2018) 651 final.
7 La cooperazione territoriale europea (“CTE”), noto anche come Interreg, è uno dei due obiettivi della politica di coesione dell’UE e fornisce un quadro per realizzare azioni comuni e scambi politici fra parti in causa di diversi Stati membri a livello nazionale, regionale e locale.
8 Study on Cross-Border Cooperation. Capitalising on existing initiatives for cooperation in cross-border regions – studio della commissione pubblicato nel marzo 2018. L’elenco dei progetti e i rispettivi obiettivi riportati nello studio sono consultabili on-line qui.
9 Comunicazione della Commissione relativa alla trasformazione digitale della sanità e dell’assistenza nel mercato unico digitale, alla responsabilizzazione dei cittadini e alla creazione di una società più sana, COM(2018) 233 final, del 25.4.2018. La comunicazione è il risultato della revisione intermedia dell’attuazione della strategia per il mercato unico digitale.
10 Belgio, Cechia, Germania, Estonia, Irlanda, Grecia, Spagna, Francia, Croazia, Italia, Cipro, Lituania, Lussemburgo, Ungheria, Malta, Paesi Bassi, Austria, Polonia, Portogallo, Slovenia, Finlandia e Svezia.
11 Dieci Stati membri hanno indicato una copertura nazionale per le prescrizioni elettroniche nel 2017 di oltre il 90 % (Croazia, Cechia, Danimarca, Estonia, Finlandia, Grecia, Italia, Portogallo, Spagna e Svezia).
12 epSOS – Smart Open Services for European Patients — progetto finanziato nell’ambito del programma per la competitività e l’innovazione (CIP), tema 3: servizi sanitari sostenibili ed interoperabili.
13 Raccomandazione del Consiglio dell’8 giugno 2009 su un’azione nel settore delle malattie rare.
14 Il comitato di Stati membri per le ERN è stato creato dalla decisione di esecuzione 2014/287/UE della Commissione, del 10 marzo 2014, che stabilisce criteri per l’istituzione e la valutazione delle reti di riferimento europee e dei loro membri e per agevolare lo scambio di informazioni e competenze in relazione all’istituzione e alla valutazione di tali reti (GU L 147 del 17.5.2014, pag. 79).
15 Strategia della Corte per il periodo 2018‑2020.
16 Danimarca, Italia, Lituania, Paesi Bassi e Svezia.
17 Direttiva di esecuzione 2012/52/UE della Commissione, del 20 dicembre 2012, comportante misure destinate ad agevolare il riconoscimento delle ricette mediche emesse in un altro Stato membro (GU L 356 del 22.12.2012, pag. 68).
18 Articolo 20 della direttiva.
19 Tali studi includono: uno studio del 2012 su un approccio basato sulle migliori pratiche adottate dai siti dei punti nazionali di controllo con raccomandazioni agli Stati membri e alla Commissione su come fornire informazioni adeguate su diversi aspetti essenziali dell’assistenza sanitaria transfrontaliera attraverso i PCN; uno studio del 2014 sull’impatto delle informazioni sulle scelte dei pazienti nel contesto della direttiva; uno studio valutativo del 2015 sul funzionamento della direttiva, contenente, inter alia, una rassegna dei siti dei PCN.
20 Secondo una indagine svolta dalla Commissione presso i PCN ai fini della relazione sul funzionamento della direttiva.
21 Commission study on cross-border health services: enhancing information provision to patients pubblicato il 20 luglio 2018.
22 Relazione sull’attuazione della direttiva sull’assistenza sanitaria transfrontaliera del 29 gennaio 2019 della Commissione per l’ambiente, la sanità pubblica e la sicurezza alimentare.
23 Relazione della riunione dei PCN del 5 maggio 2017.
24 Comunicazione della Commissione relativa alla trasformazione digitale della sanità e dell’assistenza nel mercato unico digitale, alla responsabilizzazione dei cittadini e alla creazione di una società più sana, COM(2018) 233 final, del 25.4.2018. La comunicazione è il risultato della revisione intermedia dell’attuazione della strategia per il mercato unico digitale.
25 Interim evaluation of the eHealth Action Plan 2012‑2020, studio della Deloitte preparato per la Commissione.
26 La dotazione totale del progetto era di 38 milioni di euro, di cui 18 milioni di euro a titolo di cofinanziamento approvato dall’UE. In totale, 24 paesi hanno partecipato al progetto.
27 L’importo include i servizi informatici per le ERN.
28 Relazione finale di valutazione tecnica di epSOS del 12 novembre 2014.
29 Nel 2014, l’unità Sistemi informativi della DG SANTE ha eseguito una valutazione del progetto epSOS per vedere quali erano le realizzazioni e i conseguimenti ottenuti dal progetto e trarre conclusioni sulla sua maturità per una potenziale ulteriore attuazione su larga scala.
30 Sito web della Commissione: Cross-border digital prescription and patient data exchange are taking off.
31 Sito web della Commissione: eHDSI governance.
32 Annex of the 2016 Annual Activity Report (AAR) – Health and Food Safety. Nella sua relazione annuale di attività 2017, la Commissione indicava nove Stati membri, dato che la Danimarca si era ritirata dai servizi informativi transfrontalieri per l’eHealth (cfr. paragrafo 10 e riquadro 1).
33 Cechia, Estonia, Croazia, Lussemburgo, Malta, Portogallo e Finlandia.
34 Comunicazione della Commissione “Le malattie rare: una sfida per l’Europa” COM(2008) 679 final.
35 Raccomandazione del Consiglio dell’8 giugno 2009 su un’azione nel settore delle malattie rare.
36 Comitato di esperti dell’Unione europea sulle malattie rare (EUCERD) istituito dalla decisione della Commissione del 30 novembre 2009 (2009/872/EC).
37 La Commissione ha elaborato un quadro per tale lavoro nella decisione delegata e nella decisione di esecuzione del 10 marzo 2014.
38 La relazione annuale di attività 2016 della DG SANTE (Allegato A, pag. 169) indica un target intermedio di dieci ERN per l’indicatore di risultato 1.5.A: numero di ERN costituite.
39 Articolo 4, paragrafo 5, della decisione di esecuzione 2014/287/UE della Commissione.
40 Nel campione di 50 relazioni di valutazione dei prestatori di assistenza sanitaria selezionato dalla Corte per 23 ERN, la Corte ha rilevato che 30 prestatori di assistenza sanitaria non avevano fornito informazioni su un piano di azione esplicito.
41 Articolo 14, paragrafo 5, della decisione di esecuzione 2014/287/UE della Commissione del 10 marzo 2014.
42 Terzo programma sanitario.
43 Comitato di Stati membri per le ERN, 6 marzo 2018.
44 Sulla base di un accordo amministrativo tra la DG SANTE e il JRC.
45 EUROCAT (rete europea di sorveglianza delle anomalie congenite) e SCPE (sorveglianza della paralisi cerebrale in Europa).
46 Nel novembre 2018, la rete di assistenza sanitaria on-line (eHealth) ha concesso l’autorizzazione per l’attivazione degli scambi transfrontalieri di dati sanitari via eHDSI a quattro paesi: la Finlandia può inviare le prescrizioni elettroniche mentre l’Estonia le può ricevere. La Cechia e il Lussemburgo sono autorizzati a ricevere i fascicoli elettronici dei pazienti dall’estero, ma nessuno Stato membro può ancora trasmetterli via eHDSI. Tre Stati membri (Croazia, Malta e Portogallo) hanno in programma di attivare il sistema nel primo trimestre del 2019.
47 Ogni Stato membro che ha partecipato all'eHDSI ha ricevuto finanziamenti a titolo del programma MCE per le telecomunicazioni al fine di istituire il punto di contatto nazionale per l'eHealth e avviare lo scambio transfrontaliero di dati sanitari. I tempi entro cui attuare il programma a livello nazionale rientrano nel quadro di una convenzione di sovvenzione firmata da ciascuno Stato membro con la Commissione.
48 I quattro paesi autorizzati dalla rete eHealth nel novembre 2018 ad attivare gli scambi intendono introdurre più di un servizio (l'invio e la ricezione delle prescrizioni elettroniche rappresentano due servizi diversi); i) la Finlandia ha iniziato a inviare le prescrizioni elettroniche e prevede di avviare il servizio di ricezione entro la fine del 2019; ii) l'Estonia ha iniziato a ricevere le prescrizioni elettroniche e ha in programma di avviare il servizio di invio entro la fine del 2019; iii) la Repubblica ceca è pronta sia a inviare sia a ricevere i fascicoli dei pazienti e ha in programma di iniziare a inviare e ricevere le prescrizioni elettroniche entro la fine del 2020; iv) il Lussemburgo è pronto a ricevere i fascicoli dei pazienti e ha in programma di iniziare a inviarli entro la fine del 2019. Inoltre prevede di iniziare a inviare le prescrizioni elettroniche entro la fine del 2020.
L'11 marzo la Croazia ha ricevuto una raccomandazione favorevole da parte del Gruppo di esperti degli Stati membri per l'eHDSI (eHMSEG) per l'attivazione dello scambio delle prescrizioni elettroniche (sia invio che ricezione) e dei fascicoli dei pazienti (ricezione), una volta ricevuta la conferma dagli auditor che l'ultima misura correttiva in sospeso era stata attuata con successo. Per produrre effetti, detta raccomandazione deve essere adottata dalla rete eHealth.
49 http://eur-lex.europa.eu/legal-content/IT/TXT/HTML/?uri=CELEX:12012E/TXT&from=IT.
50 In particolare: 1) le conclusioni del progetto pilota "Rare 2030" finanziato dal Parlamento europeo mirano a sostenere le future decisioni politiche, esaminare la fattibilità di nuovi approcci e proporre raccomandazioni politiche (risultati attesi entro l'inizio del 2021); 2) la valutazione del terzo programma dell'UE per la salute (attesa entro il primo semestre 2021); 3) la valutazione della direttiva 2011/24/UE concernente l'applicazione dei diritti dei pazienti relativi all'assistenza sanitaria transfrontaliera (attesa entro la fine del 2022); 4) la valutazione del programma quadro per la ricerca e l'innovazione Orizzonte 2020 (data prevista ancora da confermare).
51 https://ec.europa.eu/health/sites/health/files/cross_border_care/docs/2018_crossborder_frep_en.pdf.
Équipe di audit
Le relazioni speciali della Corte dei conti europea illustrano le risultanze degli audit espletati su politiche e programmi dell’UE o su temi relativi alla gestione concernenti specifici settori di bilancio. La Corte seleziona e pianifica detti compiti di audit in modo da conseguire il massimo impatto, tenendo conto dei rischi per la performance o la conformità, del livello delle entrate o delle spese, dei futuri sviluppi e dell’interesse pubblico e politico.
Il presente controllo di gestione è stato espletato dalla Sezione di audit I “Uso sostenibile delle risorse naturali”, presieduta da Nikolaos Milionis, Membro della Corte. L’audit è stato diretto da Janusz Wojciechowski, Membro della Corte, coadiuvato da Kinga Wiśniewska-Danek, capo di Gabinetto, e Katarzyna Radecka-Moroz, attaché di Gabinetto; Colm Friel, primo manager; Joanna Kokot, capoincarico; Nicholas Edwards, vice capoincarico e Frédéric Soblet, Aris Konstantinidis, Anna Zalega, Michela Lanzutti, Jolanta Zemailaite, auditor. Mark Smith ha fornito assistenza linguistica.

Da sinistra a destra: Frédéric Soblet, Kinga Wiśniewska-Danek, Aris Konstantinidis, Janusz Wojciechowski, Colm Friel, Joanna Kokot, Nicholas Edwards, Jolanta Zemailaite.
Per contattare la Corte
CORTE DEI CONTI EUROPEA
12, rue Alcide De Gasperi
1615 Luxembourg
LUXEMBOURG
Tel. +352 4398-1
Modulo di contatto: eca.europa.eu/it/Pages/ContactForm.aspx
Sito Internet: eca.europa.eu
Twitter: @EUAuditors
Numerose altre informazioni sull’Unione europea sono disponibili su Internet consultando il portale Europa (http://europa.eu).
Lussemburgo: Ufficio delle pubblicazioni dell’Unione europea, 2019
| ISBN 978-92-847-1938-9 | ISSN 1977-5709 | doi:10.2865/80531 | QJ-AB-19-005-IT-N | |
| HTML | ISBN 978-92-847-1913-6 | ISSN 1977-5709 | doi:10.2865/638831 | QJ-AB-19-005-IT-Q |
© Unione europea, 2019
Per qualsiasi utilizzo o riproduzione di fotografie o di altro materiale i cui diritti d’autore non appartengano all’Unione europea, occorre chiedere l’autorizzazione direttamente al titolare di tali diritti.
PER CONTATTARE L’UE
Di persona
I centri di informazione Europe Direct sono centinaia, disseminati in tutta l’Unione europea. Potete trovare l’indirizzo del centro più vicino sul sito https://europa.eu/european-union/contact_it
Telefonicamente o per email
Europe Direct è un servizio che risponde alle vostre domande sull’Unione europea. Il servizio è contattabile:
- al numero verde: 00 800 6 7 8 9 10 11 (presso alcuni operatori queste chiamate possono essere a pagamento),
- al numero +32 22999696, oppure
- per email dal sito https://europa.eu/european-union/contact_it
PER INFORMARSI SULL’UE
Online
Il portale Europa contiene informazioni sull’Unione europea in tutte le lingue ufficiali: https://europa.eu/european-union/contact_it
Pubblicazioni dell’UE
È possibile scaricare o ordinare pubblicazioni dell’UE gratuite e a pagamento dal sito EU Bookshop (https://op.europa.eu/it/publications). Le pubblicazioni gratuite possono essere richieste in più esemplari contattando Europe Direct o un centro di informazione locale (cfr. https://europa.eu/european-union/contact_it).
Legislazione dell’UE e documenti correlati
La banca dati EurLex contiene la totalità della legislazione UE dal 1951 in poi in tutte le versioni linguistiche ufficiali: http://eur-lex.europa.eu/homepage.html?locale=it
Open Data dell’UE
Il portale Open Data dell’Unione europea (http://data.europa.eu/euodp) dà accesso a un’ampia serie di dati prodotti dall’Unione europea. I dati possono essere liberamente utilizzati e riutilizzati per fini commerciali e non commerciali.
 Relazione speciale
Relazione speciale